2.2
Izolace a identifikace kvasinek
Kvasinky jsou heterotrofní jednobuněčné eukaryotní mikroorganismy, řadící se do říše Fungi. Český název dostaly pro schopnost většiny druhů zkvašovat monosacharidy, některé disacharidy, případně trisacharidy na etanol a oxid uhličitý. Kvasinky se v přírodě běžně vyskytují. Díky tomu, že snadno zkvašují různé cukry, nacházejí se pravidelně na ovoci a v potravinách bohatých na cukry. Často jsou přítomny ve vzduchu, v půdě a ve střevech živočichů.
Cukry rozkládají snadno, proteolytická a lipolytická činnost je velmi malá. Kolonie kvasinek jsou kompaktní, podobají se koloniím bakterií. Při hodnocení výsledků je třeba v případě pochybností, zda jde o kolonie kvasinek nebo bakterií, provést mikroskopické vyšetření.
Souhrn
V běžné diagnostické praxi je možno postup identifikace obecně rozdělit do čtyř fází.
- Izolace čisté kultury.
- Mikroskopické vyšetření.
- Kultivační vyšetření.
- Biochemická diagnostika.
Při určování kvasinek musíme zjistit řadu důležitých kritérií.
- Biochemické vlastnosti (charakteristické metabolické reakce).
- Morfologické vlastnosti (buněk i kolonií).
- Sexuální vlastnosti (způsoby pohlavního rozmnožování).
- Nepohlavní rozmnožování (pučení, dělení).
2.2.1
Izolace
Při izolaci získáváme monokulturu (samostatný kmen) kvasinek. Získáváme-li kvasinky z prostředí, kde byly v menšině, hovoříme o nahromaďování, nebo pomnožování. Kultivaci pak provádíme tak, aby se kvasinky přednostně pomnožily. Je-li nutné potlačit přítomné bakterie ve vzorku, očkujeme bud‘ na agarové půdy s antibiotiky např. GKCH (agar s glukózou, kvasničným extraktem a chloramfenikolem), nebo potlačíme bakterie kultivací v kyselém prostředí (SA). Pro potlačení růstu plísní se do živné půdy může přidat 0,25 % propionanu sodného.
2.2.2
Mikroskopické vyšetření
2.2.2.1
Morfologické vlastnosti
Zkoumáme tvar a velikost buněk, způsob rozmnožování, schopnost tvořit pseudomycelium nebo pravé mycelium, výskyt specializovaných buněk. Dané vlastnosti zjišťujeme nativními nebo orientačně barvenými preparáty kvasinek vyrostlých na sladinovém agaru, nebo ve sladině. Provádíme nátěr z různých částí kolonie (okraj, střed, povrch, vnitřek), protože buňky kvasinek se v různých vrstvách kolonie liší.
+
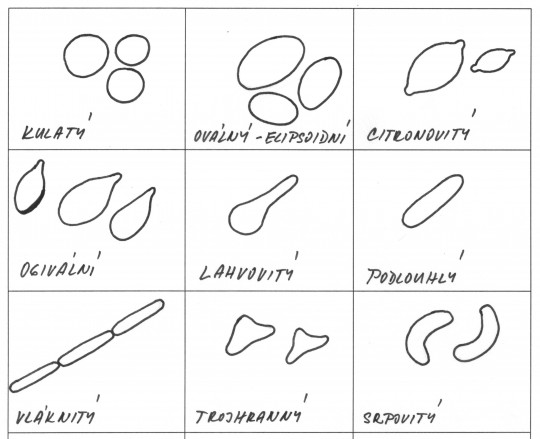
Obr. 41. Tvar kvasinkových buněk
+
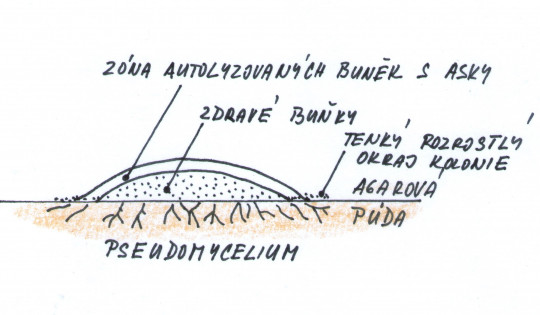
Obr. 42. Vrstvy buněk v obrovské kolonii
Minárik v roce 1963 zařadil kvasinky dle tvaru do 8 skupin označených A – H.
- A – kulaté, oválné, ojediněle mírně protáhlé, jednotlivě nebo v párech
- B – oválné, elipsovité až vejcovité, jednotlivě nebo v párech
- C – oválné až protáhnuté, jednotlivě nebo v párech
- D – kulaté až mírně oválné, často v řetízcích
- E – oválné, protáhnuté až klobásovité, jednotlivě, v párech nebo řetízcích
- F – oválné až mírně protáhnuté, velmi drobné, jednotlivé, v párech nebo krátkých řetízcích
- G – oválné, válcovité až protáhnuté, nejčastěji v řetízcích
- H – oválné až citronovité, dost malé
Mikroskopické vyšetření tvaru a velikosti buněk umožňuje např. rychlé orientační rozlišení kvasinek rodu Kloeckera a Candida nebo napomáhá při diferenciaci některých druhů s velmi podobnými fyziologickými vlastnostmi jako Sacch. carlsbergensis, Sacch. uvarum, Sacch. oviformis.
2.2.2.2
Tvorba pseudomycelia
Tvorba pseudomycelia je pomocná vlastnost při identifikaci kvasinek, je pozorovatelná u mnoha druhů kvasinek v závislosti na životních podmínkách (nedostatek uhlíku, aminokyselin apod.). Je charakteristická pro rody Candida, Pichia nebo Hansenula. Občas tvoří pseudomycelium i některé druhy kvasinek rodu Saccharomyces, Debaryomyces.
Pseudomycelium je nepravé mycelium tvořené řetízky buněk, které vznikly postupným vypučením mateřských a dceřiných buněk, v podstatě soubor nepravých hyf. Útvary, které vznikají na konci prodloužených buněk, se označují blastospory a seskupují se do chumáčů nebo nepravidelných větviček.
Nejlépe je pseudomycelium pozorovatelné na sklíčkové kultuře, která se připravuje stejně jako u plísní. Vhodnou živnou půdou je cibulový, příp. bramborový agar. Inkubuje se 5 dnů při 28 – 30 °C. Pseudomycelium můžeme pozorovat pouhým okem nebo lupou jako jemná vlákna kolem kolonie. Dokonalejší způsob hodnocení spočívá ve fixaci, obarvení a mikroskopování sklíčkové kultury.
Podle způsobu uspořádání blastospor rozeznáváme 3 základní typy pseudomycelia:
- chomáčkovité
- přesličkovité
- nepravidelné
Další možnosti jsou:
- žádné
- rudimentální
- stromečkovité
- diferencované s blastokonidiemi
+
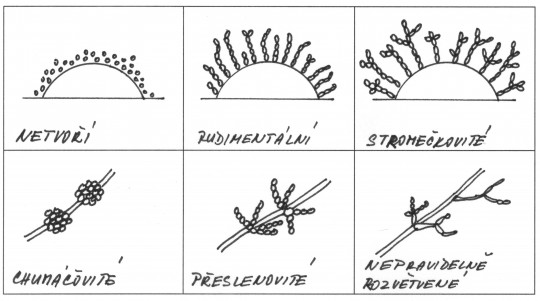
Obr. 43. Tvary pseudomycelia
+
Obr. 44. Kolonie netvořící pseudomycelium
+
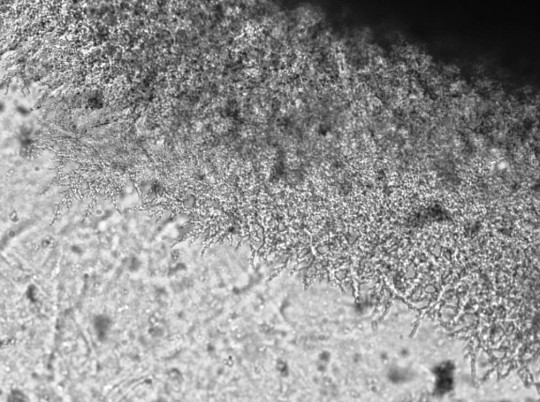
Obr. 45. Pseudomycelium
+
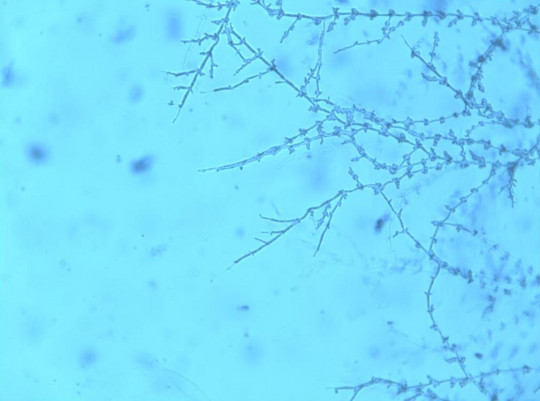
Obr. 46. Pseudomycelium
Video 1. Tvorba pseudomycelia
Příklad
Úkol: Tvorba pseudomycelia.
Mikroorganismy: kvasinky rodu Saccharomyces, Candida, Hansenula, Kloeckera, Kluyveromyces
Pomůcky: sterilní Petriho misky se zahnutou skleněnou tyčinkou a podložním sklíčkem, cibulový agar, kultury testovaných kvasinek, očkovací klička, očkovací jehla, fyziologický roztok, sterilní zkumavky, pipety
Postup:
- Připravte si aseptické prostředí a pomůcky, které budete potřebovat.
- Asepticky otevřete sterilní Petriho misku s podložním sklíčkem, které je položené na tyčince ohnuté do tvaru U a pomocí sterilní pipety na něj opatrně nakapejte rozvařený cibulový agar, tak abyste nepotřísnili dno Petriho misky.
- Zavřete misku a nechejte půdu utuhnout.
- Jednu kličku 3 dny staré kultury suspendujte v 5 ml fyziologického roztoku ve zkumavce postupným roztíráním po stěně zkumavky.
- Na ½ sklíčka naočkujte kulturu v 9 místech ve 3 řadách (očkovací jehlu namočte jen jednou a 9x se dotkněte živné půdy), druhou jehlou opakujte postup na druhé straně.
- Dno misky pokryjte sterilní vodou (2 ml).
- Misku uzavřete a kultivujte 5 dní při 28 – 30 °C.
- Po kultivaci sklíčkovou kulturu mikroskopujte při vhodném zvětšení.
Hodnocení:
Kvasinky nevytvářející pseudomycelium rostou i po 7 – 10 dnech v ostře ohraničených koloniích. Kvasinky tvořící pseudomycelium rostou v koloniích, z jejichž okrajů po 3 – 10 dnech vybíhají paprskovitě nebo nepravidelně jemná vlákna, která jsou vidět proti světlu pouhým okem a která je možno mikroskopicky určit jako více nebo méně dokonale vyvinutá a rozvětvená vlákna pseudomycelia nebo mycelia.
Závěr:
Zhodnoťte schopnost tvořit pseudomycelium u různých kvasinek. Porovnejte výsledky v rámci celé skupiny.
2.2.2.3
Sexuální vlastnosti
Tvorba askospor bývá často potlačena, zejména u kulturních kvasinek. Většinou je tedy třeba jejich tvorbu indukovat. Abychom mohli tvrdit, že kultura askospory netvoří, musíme použít více sporotvorných půd. Při indukci spor se postupuje tak, že se kvasinky nejprve kultivují v tekuté živné půdě, která je bohatá na živiny – tzv. presporulační půda. Pak následuje kultivace na agarové sporulační půdě, např. Fowellově agaru, nebo na Gorodkovové agaru při teplotě 20 – 25 °C po dobu 5 – 10 dní, růst kvasinek na těchto půdách je pomalý.
Spory kvasinek můžeme pozorovat přímo, bez diagnostického barvení, nebo je můžeme dokazovat podobně jako spory bakterií (metoda Wirtz-Conklinova). Sleduje se tvar a velikost spor a jejich počet. Protože starší kultury (sbírkové) často sporulační schopnost ztrácejí, je vhodné sporulační zkoušky dělat co nejdříve po izolaci.
2.2.2.4
Nepohlavní rozmnožování
Zjišťujeme, zda kvasinky vznikají pučením nebo dělením. Objektivní výsledky získáme přímým pozorováním procesu (sklíčková kultura, visutá kapka).
+
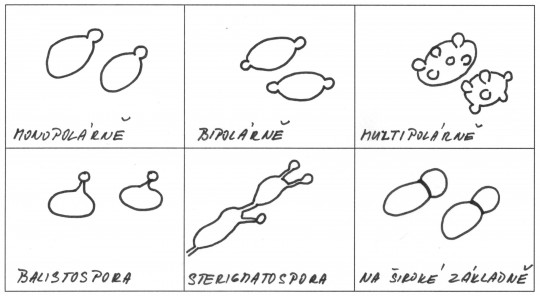
Obr. 47. Pučení kvasinek
2.2.3
Kultivační vyšetření
Hodnotíme způsob růstu na agarových a v tekutých živných půdách, obdobně jako u bakterií.
V tekutých živných půdách, je při jejich optimálním složení a teplotě, rozmnožování kvasinek v první fázi růstu rychlé a rovnoměrné v celém objemu, což se projeví jako zákal. Jak buňky dorůstají a stárnou, stávají se těžšími, nebo se shlukují, klesají na dno kultivační nádobky a vzniká sediment. Tekuté médium se vyjasňuje a zůstává čiré. Sediment může být práškovitý nebo seskupený v nepravidelných shlucích – agregátech.
U nevětraných kultur vznikají ve spodních částech tekutého prostředí mikroaerobní až anaerobní podmínky. Skutečně aerobní podmínky jsou pouze v tenké vrstvě při hladině tekutého média, kde dochází k povrchovému růstu kvasinek, které vykazují aerobní charakter metabolismu (např. rody Candida, Pichia, Hansenula). Kvasinky vytvářejí povrchový film, kožku, která může být:
- hrubá, kožovitá, skládající se téměř výlučně z pseudomyceliárních buněk
- tenká, matná, pokrčená
- velmi jemná, často jen ostrůvkovitá, nesouvislá, nebo jako prstenec kolem tekutého prostředí v kultivační nádobě
+
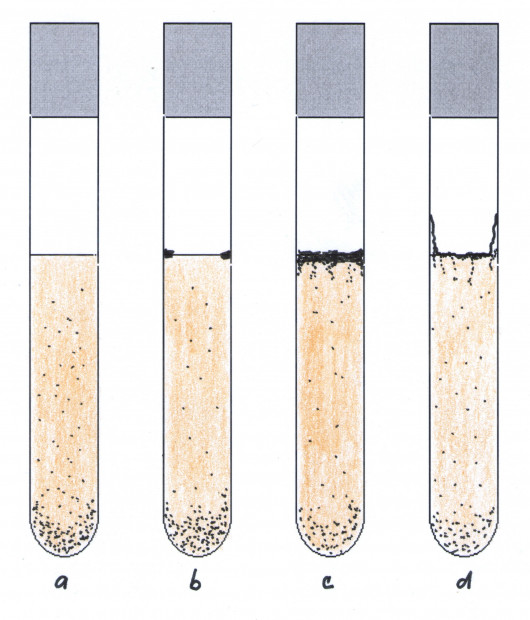
Obr. 48. Charakter růstu v tekutých živných půdách: a) zákal a usazenina, b) usazenina a prstenec, c) usazenina a hrubá kožka, d) usazenina a tenká, zvrásněná, po stěnách zkumavky rostoucí kožka
+

Obr. 49. Růst kvasinek ve sladince
+

Obr. 50. Růst kvasinek ve sladince
Někdy se v tekutých půdách tvoří slizovité útvary, např. u rodů Rhodotorula, Sporobolomyces, Cryptococcus.
Na agarových půdách zjišťujeme morfologii kolonií. Vzhledu kolonií se dříve nesprávně přisuzovala velká taxonomická hodnota při klasifikaci kvasinek. Morfologické vlastnosti kultur můžou být různé. Jejich popis se shoduje s popisem kolonií bakterií.
+

Obr. 51. Typy okrajů a povrchů kolonií
+
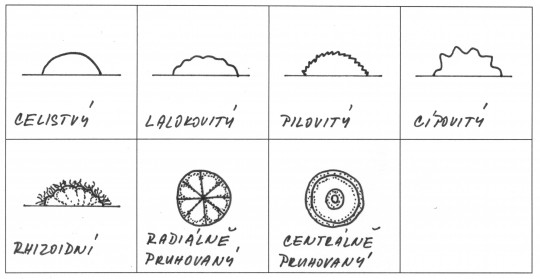
Obr. 52. Typy povrchů a okrajů kolonií
+

Obr. 53. Různé typy průřezů kolonií
2.2.3.1
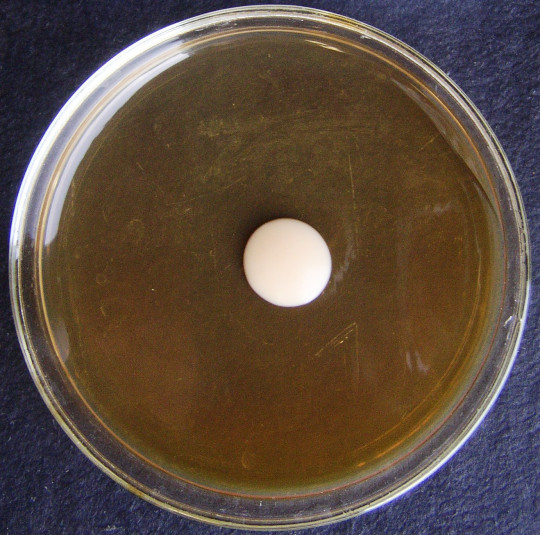
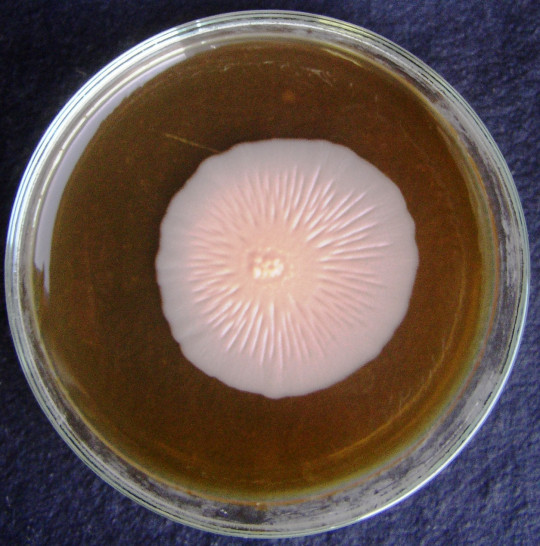
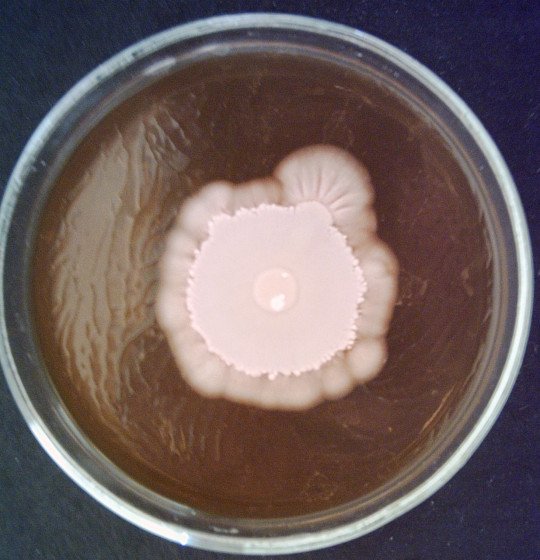
Tvorba velkých kolonií
Princip:
Kolonie se mohou vytvářet z jedné buňky, což jsou jednobuněčné kolonie, nebo z jedné spory, to jsou monosporické kolonie. Pokud se vytváří z většího počtu buněk a z různých elementů životního cyklu kultury, pak se jedná o obrovské kolonie. U všech typů kolonií posuzujeme, zda je kolonie hladká – S (smooth), drsná – R (rough), sliznatá – M (mucous). Dále se posuzuje konzistence, radiální nebo koncentrické rýhování, okraje kolonie, barva, papily. Zajímavý je vznik papil, na povrchu kolonií, které se mohou odlišovat barevně od základu kolonie a mohou mít také jiné fyziologické vlastnosti, např. jiný typ kvašení sacharidů.
Charakter obrovských kolonií závisí především na tvaru a velikosti vegetativních buněk. Malé kulovité buňky haploidních stádií vytvářejí obrovské kolonie hladké a kompaktní. Kmeny s velkými a protáhlými buňkami, které se často vyskytují v rodech Candida, Hansenula, Pichia apod., vytvářejí často drsné, kožovité i suché, moučnaté a rozprostřené kolonie.
Pro charakteristiku kmene kvasinek má význam rychlost narůstání obrovské kolonie a její konečná velikost. Posuzuje se rychlost radiálního růstu, což je přírůstek průměru kolonie v mm za 100 hodin.
Postup:
Velké kolonie se připraví nanesením většího množství inokula očkovací kličkou do středu sladinového agaru. Petriho misky se kultivují při 28 °C 24 hodin, pak se změří průměr v mm a dál se inkubují při teplotě 20 °C. Průměr vytvořené kolonie se měří po 1, 2, 3 a 4 týdnech.
Hodnocení:
Sleduje se jejich tvar, velikost, konzistence, povrch, okraje, kolmý průřez a lesk. Vypočítá se rychlost radiálního růstu.
+

Obr. 54. Ukázka velké kolonie
+
Obr. 55. Ukázka velké kolonie
+

Obr. 56. Ukázka velké kolonie
+
Obr. 57. Ukázka velké kolonie
+
Obr. 58. Ukázka velké kolonie
+
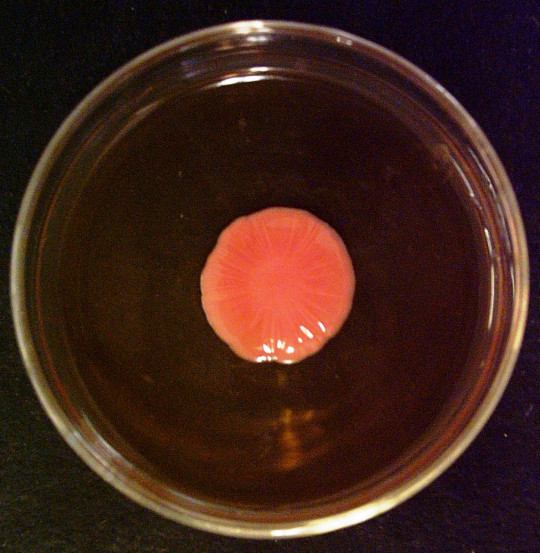
Obr. 59. Ukázka velké kolonie
+

Obr. 60. Ukázka velké kolonie
2.2.3.2
Usazenina, kožka, prstenec
Princip:
Tvorba kožky patří k důležitým rozlišovacím znakům jednotlivých kvasinek. Některé druhy kvasinek vytvářejí povrchový film „kožku“, která může být hrubá, kožovitá, tenká, matná, pokrčená, jemná nesouvislá, nebo jako prstenec kolem tekutého média v kultivační nádobě. Kvasinky s aerobním metabolismem tvoří kožku i prstenec po obvodu kultivační nádoby, kvasinky s anaerobním metabolismem tvoří sedlinu, případně prstenec. Mezi kvasinky charakteristické touto vlastností patří např. Hansenula anomala, Candida vini, Candida zeylanoides, Candida crusei a Pichia membranaefaciens.
Postup:
Čistá kultura se očkovací kličkou přenese do kultivačních baněk se sterilní nechmelenou sladinkou. Vzhled kožky se popisuje po 3 – 30 dnech kultivace při 25 °C.
Hodnocení:
Posuzuje se tvorba a také doba, za jakou je schopna kvasinka kožku vytvořit. Některé kvasinky tvoří kožku za 3 – 4 týdny, ale většinou ji tvoří v rozmezí 24 – 64 hodin. Této skutečnosti je možné využít při rozlišování druhů Candida vini, která vytváří silnou, vzlínající kožku po 24 – 48 hodinách a Candida zeylanoides, která vytváří za 4 – 6 týdnů jen nedokonalou kožku po obvodě stěn kultivační nádoby.
Růst kvasinek, které kožku nevytvářejí, se projevuje tvorbou usazeniny na dně kultivační nádoby. Sediment může být práškovitý nebo seskupený v nepravidelných shlucích (agregátech). Usazenina může být slabá nebo bohatá, řídká nebo pevná, vločkovitá nebo slizovitá. Všechny tyto znaky jsou druhově specifické, například Saccharomyces cerevisiae nikdy nevytváří kožku, kdežto tvorba tenkých šplhajících kožek je charakteristická pro rody Hansenula, Pichia, Debaryomyces apod. Často se u kvasinek vytvářejících usazeninu vyskytuje více či méně vyvinutý prstenec.
+

Obr. 61. Růst v tekutém médiu
2.2.4
Fyziologické a biochemické vyšetření
Mezi fyziologické a biochemické vlastnosti zahrnujeme tyto charakteristiky kvasinek: optimální teplota růstu, produkce barviv, tvorba polysacharidových pouzder, růst v médiu s vitamíny a bez nich, zkvašování diagnostických cukrů, asimilace různých zdrojů uhlíku, asimilace různých sacharidů, asimilace různých zdrojů dusíku, asimilace etanolu jako jediného zdroje uhlíku, osmofilie, přednostní kvašení glukózy a fruktózy, štěpení β-glykosidů, asimilace maltotriózy a maltotetraózy, ztekucování želatiny. Běžně se používají jen nejdůležitější z těchto testů.
2.2.4.1
Zkvašování sacharidů
Princip:
Důležitou fyziologickou vlastností kvasinek a kvasinkovitých mikroorganismů je jejich enzymová činnost. Při identifikaci si všímáme především jejich schopnosti zkvašovat jednotlivé druhy cukrů. Zjišťujeme je tzv. kvasnými zkouškami ve zkumavkách s plynovkami a řídíme se přitom pravidlem Kluyverovým-Stellingovým-Dekkerové.
Nejdříve zkoušíme zkvašování maltózy a sacharózy. Zkvašuje-li mikroorganismus alespoň jeden zkoušený disacharid, zkvašuje vždy i monosacharidy glukózu, fruktózu a manózu. Zkvašování maltózy znamená současně nezkvašování laktózy, naproti tomu zkvašuje-li sacharózu, může i nemusí zkvašovat laktózu. Nezkvašuje-li mikroorganismus ani maltózu, ani sacharózu, je nutno zkoušet zkvašování glukózy. Zkvašuje-li glukózu, zkvašuje i fruktózu a manózu. Nezkvašuje-li glukózu, nezkvašuje žádný jiný monosacharid, disacharid ani trisacharid.
Rozdělení kvasných typů podle Kockové-Kratochvílové
KVASNÝ TYP | I. | II. | III. | IV. |
Maltóza | + | + | - | - |
Sacharóza | - | + | + | - |
Postup:
Tekutá živná půda ve zkumavce s plynovkou obsahuje zkoušený cukr (glukóza, galaktóza, sacharóza, maltóza, rafinóza) a indikátor bromtymolovou modř. Po zaočkování zkumavky suspendováním kličkou kultivujeme při 30 °C 3 dny. Podle změny barvy a tvorby plynu v plynovce usuzujeme na pozitivní a negativní reakci.
Hodnocení:
Nejprve stanovíme příslušnost ke kvasnému typu podle zkvašování maltózy a sacharózy. Podle výsledků se očkují další testy. Vývoj plynu se sleduje po dobu až 3 týdnů.
2.2.4.2
Asimilace diagnostických cukrů
Princip:
Je to druhá nejdůležitější identifikační zkouška. Kvasinky, které zkvašují určitý disacharid, ho musí v aerobní kultuře i asimilovat. V takovém případě se zkouška asimilovatelnosti už neprovádí. Opak vždy neplatí. Jestliže kultura asimiluje určitý sacharid, může ho zkvašovat, ale také nemusí. Proto se asimilační testy provádějí pouze u cukrů, které kvasinky nezkvašují. Používají se 2 metody:
- na zpevněné půdě
- v tekutém prostředí dle Wickerhama a Bortona
Postup:
Do předem připravených sterilních zkumavek opatřených zátkou se odměří 5 ml sterilního roztoku, 2 kapky kvasniční vody, 1 kapka třídenní suspenze kvasinek. Zkumavky se kultivují při 25 °C po dobu 21 dnů.
Hodnocení:
Spočívá v posouzení zákalu ve zkumavce proti černým čarám narýsovaným na bílém papíře. Výsledek je pozitivní pokud čáry nelze rozeznat, jsou nejasné nebo neostré. Tento způsob hodnocení je subjektivní a může vést k chybným závěrům.
2.2.4.3
Asimilace etanolu jako jediného zdroje uhlíku
Princip:
Sleduje se využití etanolu jako jediného zdroje uhlíku. Tato zkouška slouží jako doplňkový ukazatel fyziologických vlastností některých druhů kvasinek. Má kladný výsledek pouze u aerobních druhů jako jsou Candida, Hansenula a Pichia. Provádí se v tekutém prostředí bez glukózy a se (NH4)2SO4 jako zdrojem dusíku. Jediným zdrojem uhlíku je 3% etanol.
Postup:
Do zkumavek odměříme 5 ml kultivačního média, 2 kapky kvasniční vody a 1 kapku 3% etanolu, očkujeme 1 kapku třídenní kultury kvasinek. Kontrolou je zkumavka bez etanolu. Kultivujeme 7 – 14 dní při teplotě 25 °C.
Hodnocení:
Při vyhodnocení se posuzuje tvorba kožky a růst kvasinek.
2.2.4.4
Asimilace dusičnanu
Princip:
Na základě schopnosti kvasinek asimilovat dusičnany můžeme oddělit některé fyziologicky příbuzné druhy. Rod Hansenula asimiluje dusičnany velmi dobře oproti rodu Pichia, který tuto schopnost nemá. Zkouška se provádí v tekutém syntetickém médiu s glukózou a KNO3. Jako kontrola slouží zkumavka s tím samým médiem, ale se (NH4)2SO4 jako jediným zdrojem dusíku.
Postup:
Do zkumavek odměříme 5 ml kultivačního média, 2 kapky kvasniční vody a očkujeme 1 kapku třídenní kultury kvasinek, kultivujeme při 25 °C a růst se hodnotí vizuálně 3 týdny po naočkování.
Hodnocení:
Výsledek zkoušky je pozitivní, pokud se na dně zkumavek s dusičnanovou formou dusíku vytvoří více sedimentu než na dně zkumavek s amoniakální formou dusíku.
2.2.4.5
Test s kyselinou fosfomolybdenovou
Princip:
Test je důkazem lokalizace invertázy v buněčné stěně. Kmeny, které rychle a silně kvasí sacharózu, dávají pozitivní výsledek.
Postup:
Kultivační médium se smíchá s roztokem kyseliny fosfomolybdenové a vylije se na Petriho misky, po utuhnutí se očkuje třídenní kulturou v přímé čáře, inkubuje se při 25 °C po dobu 5 dnů.
Hodnocení:
Sleduje se barva nátěru (bílá, bledě modrá, hnědá, olivová, tmavě modrá) a difúze barviva do agaru. Kmeny, které rychle a silně kvasí sacharózu, dávají tmavě modrý nátěr.
Příklad
Úkol: Nácvik identifikace kvasinek.
Mikroorganismy: kvasinky rodu Saccharomyces, Candida, Hansenula, Kloeckera, Kluyveromyces
Pomůcky: sterilní Petriho misky, příslušné polotuhé živné půdy, příslušné tekuté živné půdy, kultury testovaných mikroorganismů, očkovací jehla, očkovací klička, pomůcky na barvení
Postup:
- Připravte si aseptické prostředí a pomůcky, které budete potřebovat.
- U testovaných kultur proveďte vitální barvení kvasinek.
- Podle postupu zaočkujte vybrané testy.
- Jednotlivé testy kultivujte při optimální teplotě a době.
- Po kultivaci testy vyhodnoťte a výsledky zapište do tabulky.
Hodnocení:
Vyhodnoťte jednotlivé testy. Získané výsledky zapište do tabulky a podle identifikačního klíče ověřte, zda se výsledky shodují s použitou známou kulturou.
Závěr:
Zhodnoťte úspěšnost stanovení. Získané výsledky porovnejte v rámci celé skupiny.
2.2.5
Kontrolní test
Kvasinky jsou?
Co je pseudomycelium?
Jakou živnou půdu používáme při sledování tvorby pseudomycelia?
Kterou živnou půdu můžeme využít při zjišťování tvorby spór kvasinek.
Co je to kožka?
Které kvasinky jsou schopny tvořit kožku?
Podle jakého pravidla se řídíme při kvasných zkouškách kvasinek?
Kterých cukrů využíváme při zjišťování kvasných typů kvasinek?
Asimilace etanolu jako jediného zdroje uhlíku.
Co zjišťujeme testem s kyselinou fosfomolybdenovou?