2.3
Izolace a identifikace plísní
Plísně jsou eukaryotní, heterotrofní, mnohobuněčné vláknité mikroorganismy, jejichž stélku tvoří vlákna (hyfy), která mohou být přehrádkovaná i nepřehrádkovaná, jejich spleť označujeme jako mycelium (vzdušné, substrátové).
Výskyt plísní v potravinářství je až na malé výjimky, kdy se používají jako čisté kultury, nežádoucí. Plísně jsou nenáročné na životní podmínky: jsou schopné využívat vzdušnou vlhkost, rostou i za nízkých teplot, snáší vyšší osmotické tlaky, rostou v kyselém prostředí a mají obrovskou rozmnožovací schopnost.
Definice
Plísně se určují prakticky pouze podle morfologických vlastností. Rozlišujeme mikroskopické vlastnosti (mycelium a spory) a makroskopické vlastnosti (kolonie). Biochemická diagnostika, která je velmi důležitá při určování bakterií a kvasinek, se při určování běžných rodů a druhů nepoužívá.
Správná diagnostika plísní spočívá v použití standardních živných půd, správné kultivaci a kvalitní přípravě mikroskopického preparátu. Běžně se plísně kultivují na sladinovém agaru, nebo na Czapek-Doxově agaru. Při kvantitativním hodnocení předepisují normy arbitrážní agarové půdy s antibiotiky. Použitá živná půda výrazně ovlivňuje sporulaci. Sporuluje-li kultura špatně, pěstujeme ji na půdách obohacených o přirozené složky (chléb, zelenina, ovoce, části rostlin). Přesto často kultury při opakovaném očkování na umělých agarových půdách schopnost sporulace ztrácejí. Klíčivost spor je malá. Kultury je nutno alespoň 1x za 3 měsíce přeočkovat.
2.3.1
Izolace
Odlišení plísní od bakterií a kvasinek je velmi snadné. Mycelium plísní je dobře rozlišitelné pouhým okem. Při určování musíme pracovat s monokulturou. Pokud v tomto případě máme pochybnosti, provádíme izolaci. V běžné praxi můžeme určovat vícesporickou kulturu. Tedy takovou, která vznikla z více spor jednoho druhu (např. očkujeme-li kapkou nebo očkovací jehlou). Pro přesné práce, např. v genetice nebo taxonomii, musí být kultura monosporická. Nejčastěji se monosporická izolace provádí ředěním suspenze spor a jejich postupným očkováním na vhodné živné půdy. Suspenzi spor je nutno ředit tak, aby během kultivace vyrostlo na Petriho misce kolem 10 kolonií. Při větším počtu by vzhledem k velkým rozměrům kolonií byla malá pravděpodobnost, že z jedné buňky vyroste jedna kolonie. Kultivujeme při 25 °C 5 – 7 dní.
Pro základní orientaci při určování plísní většinou stačí určit makroskopické a mikroskopické vlastnosti (znaky).
2.3.2
Makroskopické morfologické znaky
Jedná se o kultivační vyšetření. Pozorujeme vzhled, barvu a vlastnosti kolonií. Je nutné si uvědomit, že na různých živných půdách se může vzhled kolonií lišit. Často používáme při posuzování habitu (vzhledu) kolonií neznámých plísní srovnávací materiál, např. sbírkové kultury, nebo trvalé preparáty.
Na vzhled mycelia a rychlost růstu může mít vliv také kultivační teplota. Základní kultivační teplota je 20 – 25 °C. Někdy, podle povahy izolátu, kultivujeme navíc ještě při teplotách 15 °C a 37 °C. Vzhled mycelia se často mění v závislosti na čase. Proto jej posuzujeme na začátku a v době plné sporulace. Hodnotíme substrátové mycelium (barva, okraje, výška, uvolňování pigmentů) a vzdušné mycelium (barva, hustota, charakter porostu, kapky vody). Důležité je rovněž zjišťování útvarů viditelných pouhým okem (sklerocia, sporangia, koremia apod.).
Z makroskopických znaků hodnotíme především:
- charakter povrchu kolonií (houževnatý, sametový, mechový, krátce nebo dlouze vláknitý, vlnitý, moučný, vločkovitý, hladký, zvrásněný)
- vzhled vzdušného mycelia (výška, hustota)
- texturu kolonií
- pigmentaci vzdušného a substrátového mycelia, vylučování pigmentu do prostředí
- vzhled fruktifikačních orgánů
- přítomnost exsudátu a jeho zbarvení
+

Obr. 62. Petriho miska určená k izolaci plísní
+
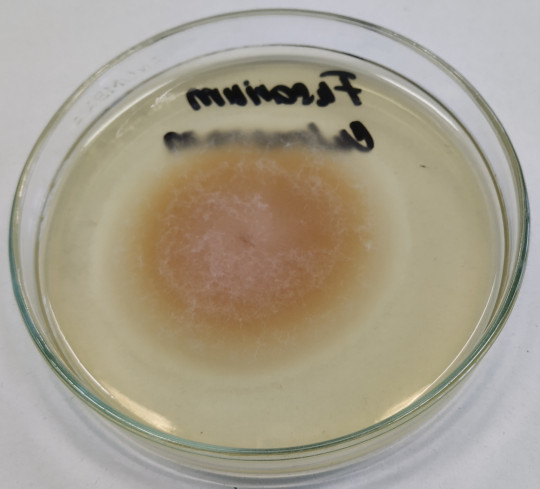
Obr. 63. Vzdušné mycelium Fusarium culmorum
+

Obr. 64. Substrátové mycelium Fusarium culmorum
+

Obr. 65. Vzdušné mycelium Alternaria alternata
+
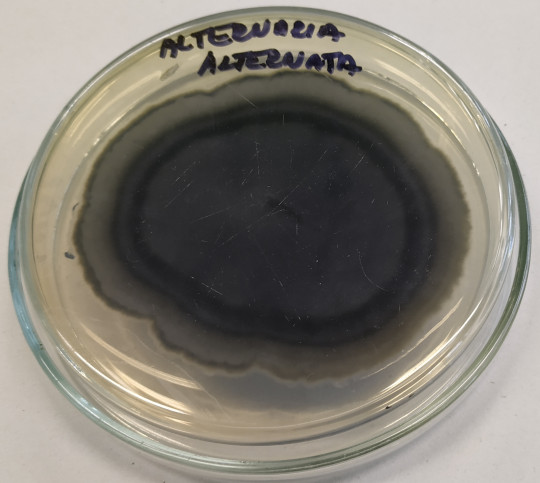
Obr. 66. Substrátové mycelium Alternaria alternata
2.3.3
Mikroskopické vyšetření
Kromě běžných morfologických vlastností, jako je šířka a větvení mycelia, tvorba přehrádek apod. nás nejvíce zajímá způsob rozmnožování (pohlavní a nepohlavní) a vlastnosti spor (tvar, velikost, vlastnosti povrchu), určují se vzhledové vlastnosti fruktifikačních orgánů.
Vyšetření provádíme pomocí nativních nebo polotrvalých preparátů a sklíčkových kultur. Jako uzavírací médium můžeme použít fyziologický roztok, 10 – 20% glycerol, kyselinu mléčnou nebo laktofenol.
Základní pojmy (vegetativní spory):
- sklerocium – polokulovitý útvar složený ze spleti hyf
- fruktifikační orgán – zvláštní útvar, na kterém se tvoří spory
- exospory (konidie) – spory umístěné vně orgánu
- endospory – nachází se uvnitř orgánů
- mikrokonidie – jednobuněčné exospory
- makrokonidie – mnohobuněčné exospory
- oidie (artospory) vznikají rozpadem vláken na jednotlivé buňky
- blastospory – tvoří se pučením
- konidie – vznikají ze základní buňky
- fialida – speciální lahvovitá buňka
- konidiofor – hyfa zřetelně odlišená od ostatních hyf
- vezikula – koncové zduření konidioforu
- metuly (primární fialidy) – vyrůstají z veziluly
- sekundární fialidy – vyrůstají ve svazcích z metul
- koremium – svazek srostlých konidioforů
- pyknidium (pyknida) – krátké konidiofory umístěné v kulovitém útvaru
- ostiola – otvor, kterým se uvolňují konidie z pyknidy
- chlamydospora – silný obal, který se vytváří kolem jednotlivých buněk mycelia
- sporangium – vakovitý útvar, ve kterém se tvoří endospory
- sporangiospory – endospory
- sporangiofor – hyfa nesoucí sporangium
- kolumela – část sporangioforu zasahujícího do kulovitého sporangia
- sporangioly – velice drobné, nahrazují u některých druhů sporangium
+
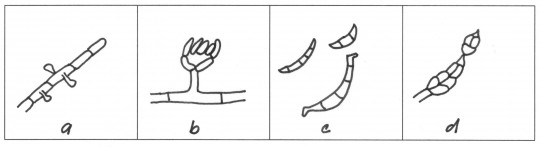
Obr. 67. Tvar a umístění exospor: a) jednotlivé spory na přehrádkovaném myceliu, b) nepravá palička spor, c) rohlíčkovité makrokonidie, d) příčně i podélně septované makrokonidie
+
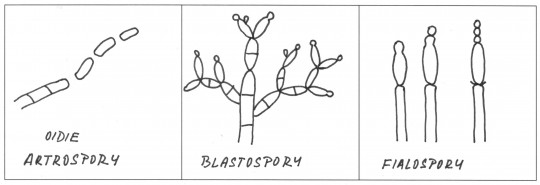
Obr. 68. Vznik exospor u plísní
+
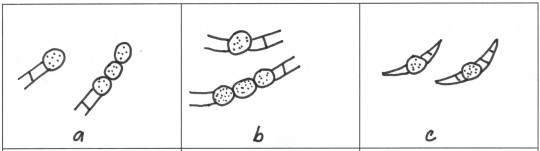
Obr. 69. Chlamydospory: a) koncové, b) interkalární, c) v makrokonidii
+
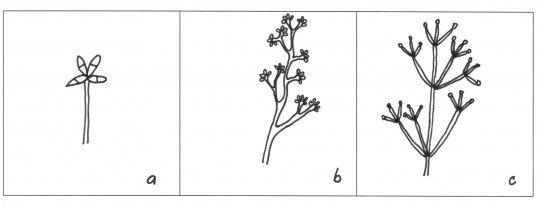
Obr. 70. Typy konidioforů: a) jednoduchý, b) nepravidelně větvený, c) přeslenovitě větvený
+
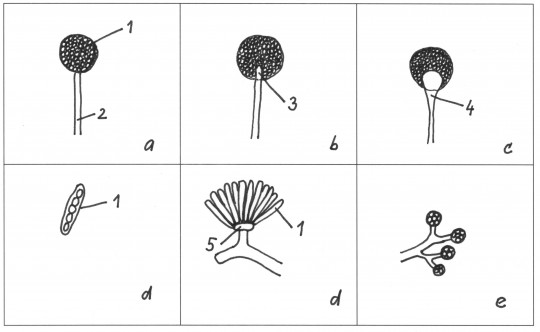
Obr. 71. Sporangia a sporangioly: a) kulovité sporangium bez kolumely, b) kulovité sporangium s kolumelou, c) kulovité sporangium s kolumelou a apofýzou, d) válcovitá sporangia, e) sporangioly, 1) sporangium, 2) sporangiofor, 3) kolumela, 4) apofýza, 5) bazální buňka
+
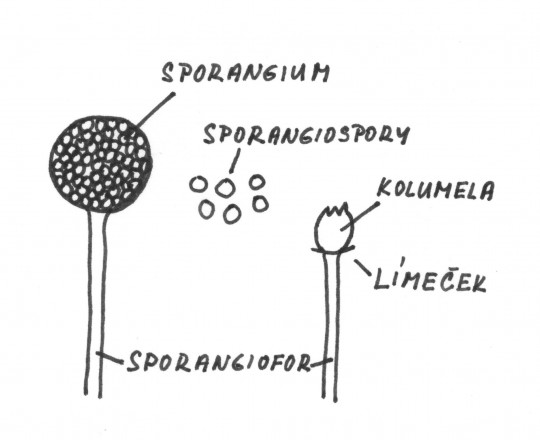
Obr. 72. Sporangiofor rodu Mucor
+
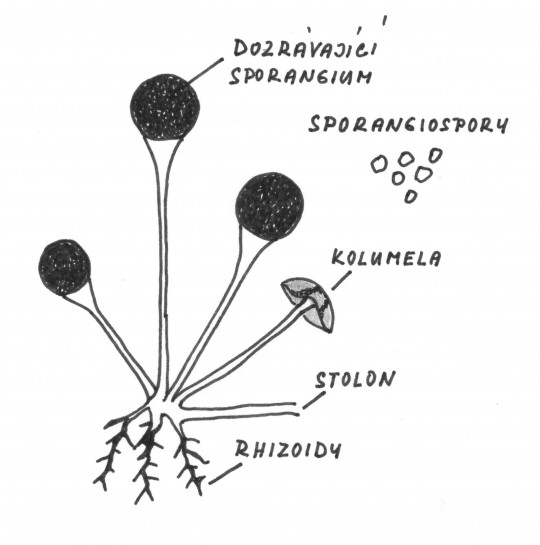
Obr. 73. Svazek sporangioforů Rhizopus stolonifer
+
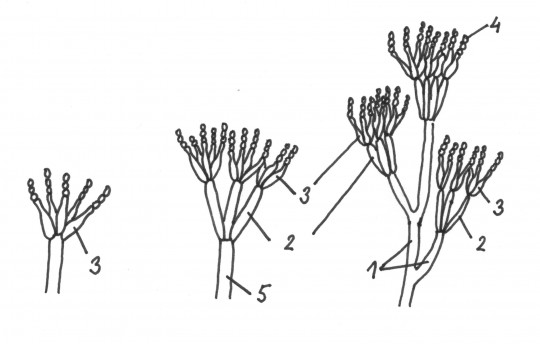
Obr. 74. Konidiofory rodu Penicillium: 1) větve, 2) metuly, 3) fialidy, 4) konidie, 5) stopka
+
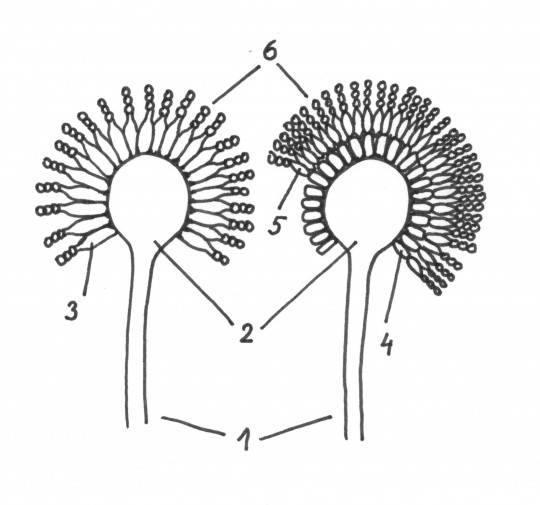
Obr. 75. Konidiofory rodu Aspergillus: 1) konidiofor, 2) vezikula, 3) fialidy, 4) metuly (primární fialidy), 5) sekundární fialidy, 6) konidie
+
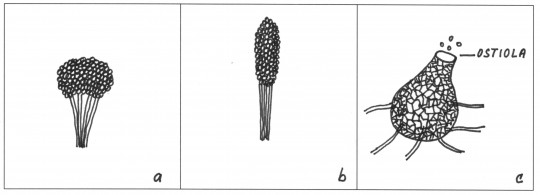
Obr. 76. Zvláštní uspořádání konidioforů: a) koremium ze stejně dlouhých konidioforů, b) koremium z různě dlouhých konidioforů, c) pyknidium
Základní pojmy (pohlavní spory):
- pohlavní spory – oospory, zygospory, askospory, bazidiospory
- zygospory – vznikají po dotknutí výběžků hyf (progametangií) a po spájení buněk (gametangií), diploidní buňka se silnou obalovou stěnou
- askospory – tvoří se po osmi v asku (vřecku)
- askus – vzniká z dvoujaderných hyf, které jsou volně nebo uzavřeny ve fruktifikačních orgánech
- kleistothecium – uzavřený fruktifikační orgán kulovitého tvaru s neuspořádanými asky
- perithecium – kulovitý útvar s uspořádanými asky
2.3.3.1
Pozorování přímo z Petriho misky
Tato jednoduchá metoda nám umožňuje sledovat mycelium v neporušeném stavu. Nevýhodou je pozorování horních částí mycelia, zhoršené prosvětlování a zaostřování.
Petriho misku s narostlou kulturou umístíme na stolek mikroskopu a pozorujeme při nejnižším zvětšení. Postupně proostřujeme struktury vzdušného mycelia. Nejlépe se mikroskopují okraje kolonií.
+

Obr. 77. Petriho miska na mikroskopu
+
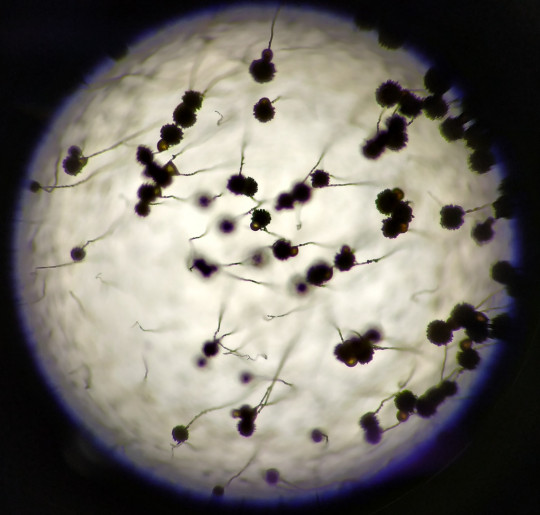
Obr. 78. Zorné pole
2.3.3.2
Laktofenolový preparát
Princip:
Při tvorbě nativního preparátu fyziologický roztok nahrazujeme laktofenolem, který preparát zároveň fixuje. Laktofenol (směs kys. mléčné, glycerolu, fenolu) dobře smáčí hyfy, konzervuje, pomalu vysychá, hyfy nebobtnají, pro lepší rozlišení se dá obarvit methylenovou modří. Zdařilé laktofenolové preparáty můžeme vhodným lakem (acetonový lak, syntetický lak) zarámovat a vytvořit trvalý preparát.
Postup:
Do kapky laktofenolu na podložním skle se sterilními preparačními jehlami přenese opatrně malá část mycelia a šetrně se rozprostře, tak aby při přenosu nedošlo k rozbití útvarů a mechanickému poškození. Pokud se nám nedaří odebrat pouze mycelium, odebíráme kulturu i s částí agaru, který pak na sklíčku oddělíme a opatrně odstraníme. Opatrně překryjeme krycím sklíčkem, tak aby se nevytvořily bublinky, přebytečný laktofenol odsajeme filtračním papírkem. Pozorujeme nejdříve při malém zvětšení, pak při zvětšení 45x. Pozorované útvary zakreslíme a popíšeme.
Hodnocení:
Hodnotíme typ mycelia (přehrádkované, nepřehrádkované, tloušťka a barva hyf, způsob větvení), charakter fruktifikačních orgánů (konidiofor, sporangiofor, větvení, zakončení), přítomnost vegetativních fruktifikačních struktur (sporangium, kolumela, sporangiospory, sterigmata – primární, sekundární, konidie), přítomnost a charakter pohlavních fruktifikačních struktur (askus, askospory, zygospory), přítomnost zvláštních útvarů (chlamydospor, sklerocií, koremií, sporodochií, pyknid, stolonů, rhizoidů).
+

Obr. 79. Preparační jehly
+
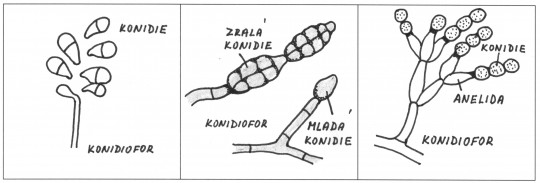
Obr. 80. Různé typy konidií
+
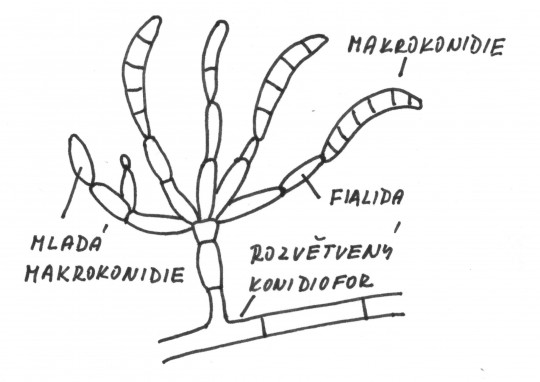
Obr. 81. Makrokonidie rodu Fusarium
+
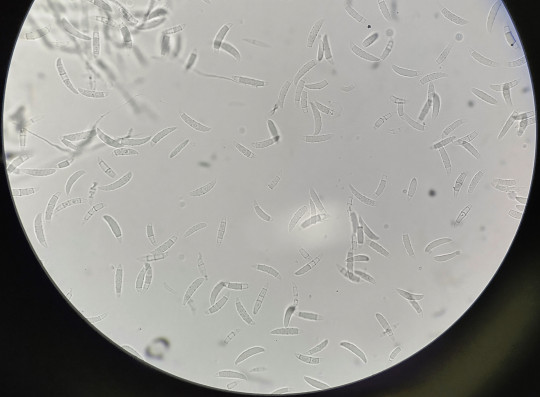
Obr. 82. Laktofenolový preparát makrokonidie Fusarium culmorum
+

Obr. 83. Laktofenolový preparát makrokonidie Alternaria alternata
2.3.3.3
Sklíčkové kultury
Jedná se o plísňovou kulturu vykultivovanou mezi podložním a krycím sklíčkem. Mycelium roste podél krycího sklíčka. Umožňují pozorování mycelia včetně všech struktur v přirozeném stavu, bez mechanického porušení.
+

Obr. 84. Petriho miska se sklíčkovou kulturou
+
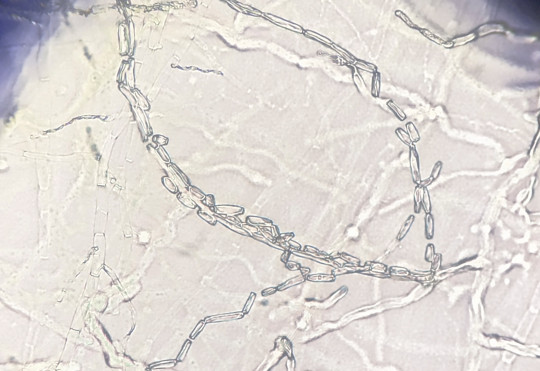
Obr. 85. Sklíčková kultura
+
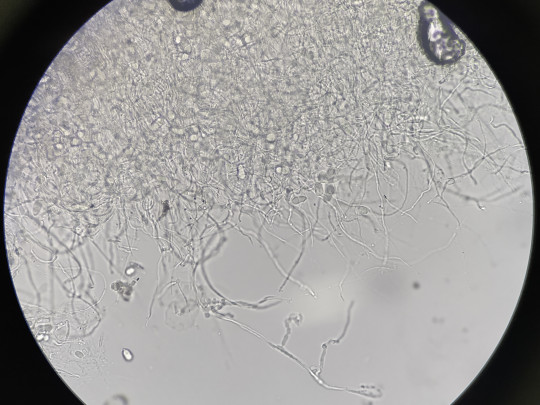
Obr. 86. Sklíčková kultura
+
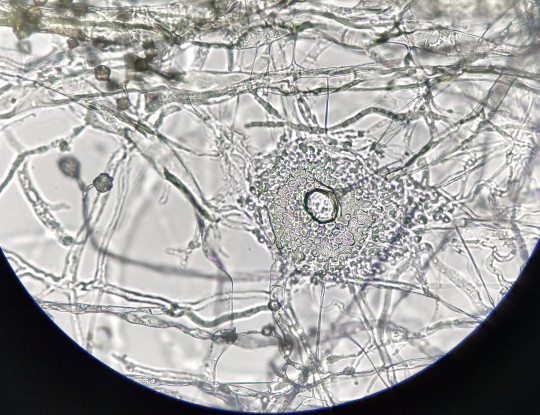
Obr. 87. Sklíčková kultura
+
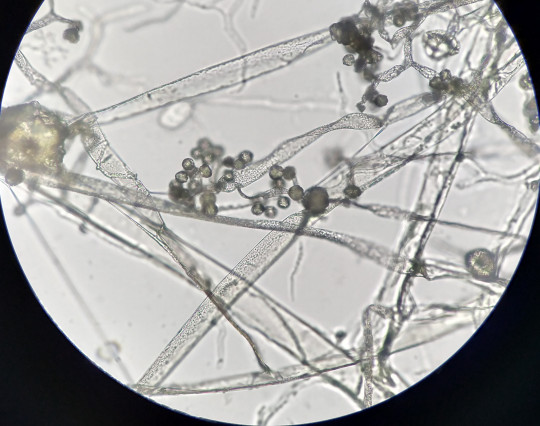
Obr. 88. Sklíčková kultura
Video 2. Sklíčková kultura
Příklad
Úkol: Připravte sklíčkovou kulturu.
Mikroorganismy: zástupci pravých a nepravých plísní
Pomůcky: sterilní Petriho misky se zahnutou skleněnou tyčinkou s podložním a krycím sklíčkem, SA, kultury testovaných plísní, očkovací jehla, skalpel, pipeta, destilovaná voda
Postup:
- Připravte si aseptické prostředí a pomůcky, které budete potřebovat.
- Do sterilní Petriho misky nalijte tenkou vrstvu (asi 2 mm) živné půdy a nechejte ve vodorovné poloze utuhnout.
- Asepticky otevřete sterilní Petriho misku s podložním a krycím sklíčkem a přeneste čtvereček sterilního agaru (5x5 mm), který vykrojíte z nalité Petriho misky skalpelem na podložní sklíčko.
- Očkovací jehlou odeberte spory z plísně a zaočkujte čtvereček lehkým dotykem.
- Živnou půdu přiložte krycím sklíčkem a podložní sklíčko dejte do Petriho misky na skleněnou tyčinku ohnutou do tvaru U.
- Na dno Petriho misky napipetujte 2 ml sterilní vody.
- Kultivujte v termostatu při 25 °C 5 – 7 dní.
- Po kultivaci sklíčkovou kulturu mikroskopujte při vhodném zvětšení.
Hodnocení:
Hodnotíme obdobně jako laktofenolový preparát. Hodnotíme typ mycelia (přehrádkované, nepřehrádkované, tloušťka a barva hyf, způsob větvení), charakter fruktifikačních orgánů (konidiofor, sporangiofor, větvení, zakončení), přítomnost vegetativních fruktifikačních struktur (sporangium, kolumela, sporangiospory, sterigmata – primární, sekundární, konidie), přítomnost a charakter pohlavních fruktifikačních struktur (askus, askospory, zygospory), přítomnost zvláštních útvarů (chlamydospor, sklerocií, koremií, sporodochií, pyknid, stolonů, rhizoidů).
Závěr:
Zhodnoťte kvalitu sklíčkových kultur. Porovnejte výsledky v rámci celé skupiny.
Příklad
Úkol: Nácvik identifikace plísní I – pravé plísně.
Princip:
Jako pravé plísně jsou označovány vláknité mikroorganismy řádu Mucorales, patřící do třídy Zygomycetes. Typickou vlastností pravých plísní je vzhled mycelia. Mycelium má většinou šedou, kouřovou, béžovou až bílou barvu. Není pastelově zbarveno. Vzdušné mycelium je často nápadně vysoké, někdy až k víčku Petriho misky. Hyfy jsou nepřehrádkované – jednobuněčné. Pro některé druhy je typická tvorba chlamydospor, které jsou poněkud odolnější, než vegetativní buňky. Nepohlavní spory (sporangiospory) jsou většinou tmavohnědé až černé. Sexuálně se rozmnožují zygosporami. Zygospory jsou zjistitelné bud‘ na čerstvých izolátech z přirozeného prostředí, nebo na laboratorních půdách obohacených o přirozené složky (seno, brambory, mrkev, švestky). Na běžných umělých laboratorních půdách je výskyt zygospor vzácný.
Mikroorganismy: rod Mucor, Absidia, Rhizopus, Thamnidium
Pomůcky: kultury pravých plísní, laktofenol, podložní a krycí sklíčka, preparační jehly
Postup:
- Připravte si aseptické prostředí a pomůcky, které budete potřebovat.
- Pozorujte charakteristický vzhled kolonií.
- U testovaných kultur plísní proveďte mikroskopické vyšetření mikroskopováním kultur na Petriho misce, laktofenolových preparátů a sklíčkových kultur.
- Výsledky mikroskopování zakreslete a slovně popište.
Hodnocení:
Získané výsledky zapište a zakreslete do tabulky a podle identifikačního klíče ověřte, zda se výsledky shodují s použitou známou kulturou.
Závěr:
Zhodnoťte úspěšnost identifikace. Porovnejte výsledky v rámci celé skupiny.
Příklad
Úkol: Nácvik identifikace plísní II – nepravé plísně.
Princip:
Jako nepravé plísně bývají označovány plísně, které tvoří přehrádkované, mnohobuněčné mycelium. Systematicky jsou zařazovány do třídy Ascomycetes nebo Deuteromycetes, podle způsobu pohlavního rozmnožování. U některých rodů existují druhy, které se pohlavně nerozmnožují. Na tvorbu askospor můžeme často usoudit podle vzhledu mycelia. Pouhým okem bývají patrná drobná žlutá kleistothecia, v kterých vznikají asky s askosporami. Prakticky nejvýznamnější plísně patří do čeledi Moniliaceae a Dematiaceae.
Čeleď Moniliaceae
Mycelium je většinou světlé, jasné, rozmnožování je bud‘ vegetativní, nebo exosporami. Nejrozšířenější, druhově nejpočetnější a také nejvýznamnější jsou rody Penicillium a Aspergillus. Další rody Monilia, Scopulariopsis, Geotrichum, Trichothecium, Botrytis, Sporotrichum, Trichoderma.
Čeleď Dematiaceae
Společnou charakteristickou vlastností příslušníků této čeledi je tvorba tmavého substrátového mycelia. Vzdušné mycelium bývá zpravidla také tmavé – zelené, hnědé až černé. Rod Alternaria, Cladosporium, Fusarium, Phoma.
Mikroorganismy: zástupci nepravých plísní
Pomůcky: kultury nepravých plísní, laktofenol, podložní a krycí sklíčka, preparační jehly
Postup:
- Připravte si aseptické prostředí a pomůcky, které budete potřebovat.
- Pozorujte charakteristický vzhled kolonií.
- U testovaných kultur plísní proveďte mikroskopické vyšetření mikroskopováním kultur na Petriho misce, laktofenolových preparátů a sklíčkových kultur.
- Výsledky mikroskopování zakreslete a slovně popište.
Hodnocení:
Získané výsledky zapište a zakreslete do tabulky a podle identifikačního klíče ověřte, zda se výsledky shodují s použitou známou kulturou.
Závěr:
Zhodnoťte úspěšnost identifikace. Porovnejte výsledky v rámci celé skupiny.
2.3.4
Kontrolní test
Plísně jsou?
Základní kultivační teplota plísní je?
Makroskopické morfologické znaky plísní zahrnují?
Jaké mycelium rozeznáváme?
Plísně se identifikují?
Jaké mikroskopické preparáty připravujeme při identifikaci plísní?
Co je laktofenol?
K čemu slouží sklíčková kultura?
Při jakých podmínkách nejčastěji kultivujeme plísně?
Jaké vlastnosti se využívají při identifikaci plísní?