2.6
Kritický stav a zkapalňování reálných plynů
Reálný plyn je na rozdíl od ideálního plynu za určitých podmínek zkapalnitelný. K vysvětlení využijme představu plynu uzavřeného do válce a stlačovaného pístem. Bude-li pokus prováděn při konstantní teplotě, můžeme jej zaznamenat v souřadnicovém systému p – V graficky jako izotermu. Na obrázku č. 6 je nakreslena jedna taková izoterma. Šipka znázorňuje směr stlačování objemu plynu. V bodě a je původní nestlačený plyn. Při stlačování téměř do bodu b dochází ke zmenšování objemu plynu a vzrůstu tlaku. V bodě b se molekuly spojují do větších celků a vznikají mikrokapičky. Plyn kondenzuje. Tlak, při kterém ke kondenzaci dochází, nazýváme kondenzační. Dalším stlačením se již tlak nezvyšuje a zkapalňování pokračuje. Změna objemu se vyrovná přeměnou odpovídajícího množství plynu na kapalinu – viz bod c. V bodě d je už všechen plyn zkapalněn. Po ukončení kondenzace vyvolá i nepatrné zmenšení objemu velké zvýšení tlaku, neboť kapaliny jsou téměř nestlačitelné.
+
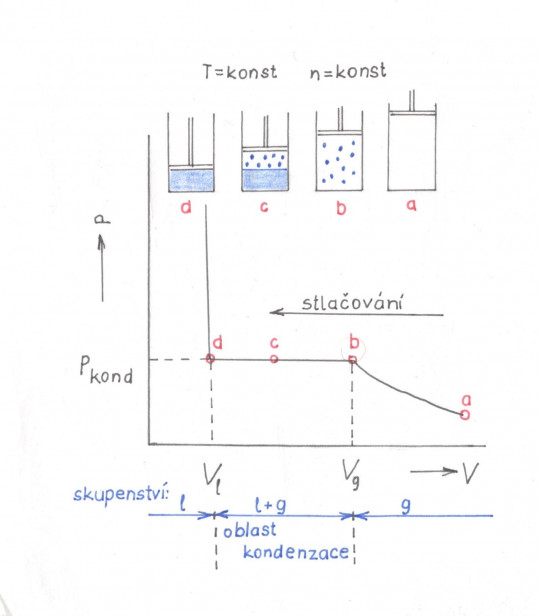
Obr. 6. Izoterma znázorňující zkapalňování plynu
Na obrázku č. 7 je vyznačeno několik izoterm reálného plynu. Oblast rovných úseků je v grafu vybarvena modře a nazývá se oblast zkapalňování. Nejvyšší bod oblasti je tzv. kritický bod. Jeho polohu lze označit pomocí hodnot Tk, pk, Vk, tj. kritická teplota, kritický tlak, kritický objem.
+
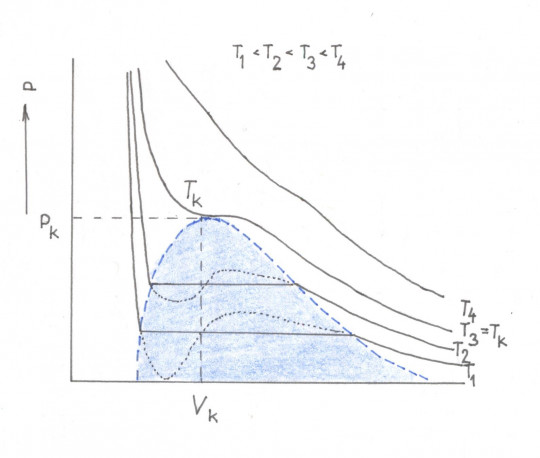
Obr. 7. Izotermy zkapalňování plynu
Poznámka
V oblasti zkapalňování jsou přímky, které odpovídají naměřeným hodnotám. Čárkovaně vyznačené vlnovky zobrazují hodnoty získané výpočtem z van der Waalsovy rovnice.
Na grafu č. 7 lze vidět izotermu plynu (pro teplotu T4), která neprochází oblastí zkapalnění. Plyn nelze zkapalnit.
Z uvedených poznatků vyplývá, že pro zkapalnění musí být splněny následující podmínky:
- Plyn musí být ochlazen minimálně na kritickou teplotu Tk; raději však ještě o něco nižší.
- Je nutno zvolit kritický tlak pk. Je-li ochlazen plyn na teplotu menší, než je kritická teplota, stačí použít nižší tlak.
Podle hodnoty Tk se plyny dělí na:
- snadno zkapalnitelné (CO2, NH3, SO2, Cl2, ...), jejichž Tk je vyšší než běžná teplota, takže je stačí jen stlačit,
- nesnadno zkapalnitelné (He, Ne, Ar, N2, O2, ...), jejichž kritické teploty jsou nízké.
Tabulka 2. Kritické hodnoty vybraných plynů
plyn | Tk [K] | pk [MPa] | Vk [cm3 ∙ mol-1] |
CO2 | 304,17 | 7,386 | 94,3 |
NH3 | 405,6 | 11,350 | 72,0 |
He | 5,19 | 0,227 | 57,8 |
N2 | 126,2 | 3,390 | 59,0 |
O2 | 154,58 | 5,043 | 73,4 |
Pro zkapalnění plynů s nízkými kritickými teplotami se využívá Joulův–Thomsonův jev [čti: džaulův–tomsnův].
Stlačený plyn proudí škrticím ventilem do prostoru s vyčerpaným vzduchem, a tudíž velmi nízkým tlakem. Dojde k expanzi plynu. Byla-li teplota stlačeného plynu na začátku nižší než tzv. inverzní teplota, pak dojde k ochlazení plynu. Pokud byla teplota vyšší než inverzní, pak se plyn ohřeje.
+
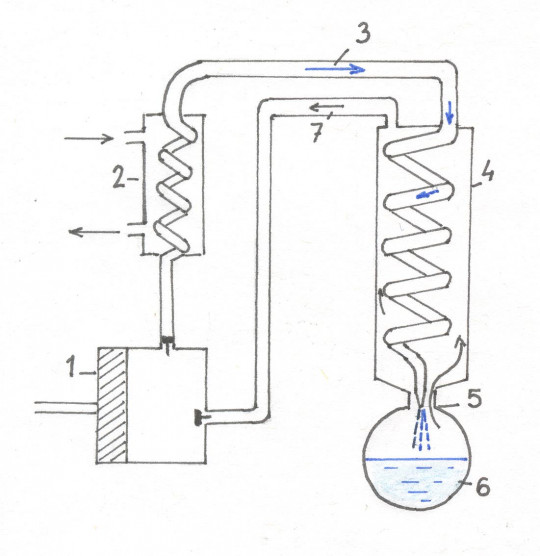
Obr. 8. Aparatura ke zkapalňování plynu (1 – kompresor, 2 – chladič, 3 – stlačený plyn, 4 – výměník tepla, 5 – škrticí ventil, 6 – zkapalnělý plyn, 7 – expandovaný plyn)
Inverzní teplota se vypočítá s použitím van der Waalsových konstant podle vzorce:
Většina plynů se za běžné teploty 20 °C bude ochlazovat. Naopak helium a vodík mají velmi nízké inverzní teploty, a proto se za běžné teploty budou ohřívat. Zkapalněné helium je snazší získat destilací zkapalněného vzduchu.