2.1
Die wichtigsten Elemente und Verbindungen
Sauerstoff
Sauerstoff ist das chemische Element mit dem Symbol O und der Ordnungszahl 8, was bedeutet, dass sein Kern 8 Protonen hat. Die Anzahl der Neutronen kann je nach Isotop variieren: Die stabilen Isotope haben 8, 9 oder 10 Neutronen. Sauerstoff zählt im Periodensystem zu den Chalkogenen und ist ein hochreaktives Nichtmetall und ein Oxidationsmittel, das mit den meisten Elementen und anderen Verbindungen auch Oxide bildet. Sauerstoff ist nach Wasserstoff und Helium das dritthäufigste Element im Universum. Bei Standardtemperatur und Druck bindet es typischerweise an Disauerstoff, ein farbloses und geruchsloses zweiatomiges Gas mit der Formel O2. Dieses Gas macht 20,8% der Erdatmosphäre aus. Sauerstoff mach in Form von Verbindungen, einschließlich Oxiden, ungefähr die Hälfte der Erdkruste aus.
Disauerstoff (Dioxygen) ist wichtig für die Zellatmung und viele Bestandteile lebender Organismen enthalten Sauerstoff wie Proteine, Nukleinsäuren, Kohlenhydrate und Fette. Es ist auch der Hauptbestandteil anorganischer Verbindungen bei Tierschalen, Zähnen und Knochen. Disauerstoff ist der Hauptbestandteil von Wasser, das wiederum der Hauptbestandteil aller Lebensformen ist. Durch Photosynthese wird in der Atmosphäre kontinuierlich Sauerstoff erzeugt. Bei der Photosynthese handelt es sich um die Reaktion, bei der die Energie des Sonnenlichts genutzt wird und aus Wasser und Kohlendioxid Sauerstoff hergestellt wird. Ozon (O3) ist eine andere Form von Sauerstoff, es absorbiert stark UVB-Strahlung und die Ozonschicht in großer Höhe trägt zum Schutz der Biosphäre vor Ultraviolettstrahlung bei.
+
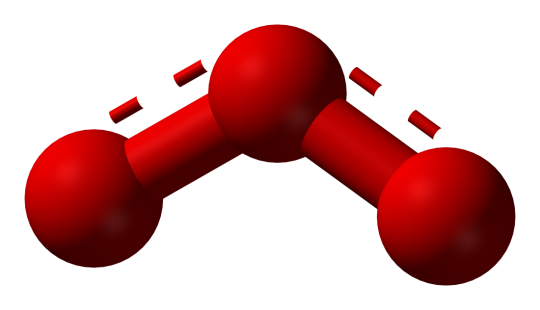
Quelle: Urheber Ben Mills, Ozone-CRC-MW-3D-balls, Genehmigung Public domain.
Fig. 3. Ozon.
Wasserstoff
Wasserstoff hat das Symbol H und die Ordnungszahl 1. Er ist das leichteste Element des Periodensystems und ist eine farblose, geruchlose, geschmacksneutrale und brennbare gasförmige Substanz. Er ist das einfachste chemische Element. Der Kern des Wasserstoffatoms hat ein Proton mit einer Einheit positiver elektrischer Ladung und ein Elektron mit einer Einheit negativer elektrischer Ladung. Unter normalen Bedingungen ist Wasserstoff ein Molekül mit zwei Atomen, ein zweiatomiges Molekül, H2. Wasserstoff verbindet sich mit Sauerstoff zu Wasser, H2O. Er kommt als Teil des Wassers in Ozeanen, Packeis, Flüssen, Seen und der Atmosphäre vor. Wasserstoff ist als Teil von Kohlenstoffverbindungen in allen tierischen und pflanzlichen Geweben sowie in Erdöl vorhanden.
Kohlenstoff
Das Element Kohlenstoff hat das Symbol C und die Ordnungszahl 6. Er ist nichtmetallisch und vierwertig – vier Elektronen stehen zur Bildung kovalenter chemischer Bindungen zur Verfügung. Es gehört zur Gruppe 14 des Periodensystems. Drei Isotope kommen auf natürliche Weise vor, wobei 12C und 13C stabil sind, während 14C ein Radionuklid ist, das mit einer Halbwertszeit von etwa 5,730 Jahren zerfällt. Es ist das Isotop, auf das der Radiokarbondatierung und der radioaktiven Markierung zurückgegriffen wird.
Kohlenstoff ist das 15 häufigste Element in der Erdkruste und nach Wasserstoff, Helium und Sauerstoff das vierthäufigste Element im Universum. Die Eigenschaften von Kohlenstoff machen ihn zu einem gemeinsamen Element alles bekannten Lebens. Er ist nach Sauerstoff das zweithäufigste Element im menschlichen Körper nach Masse (etwa 18,5%).
Elementaren Kohlenstoff gibt es in verschiedenen Formen und jede von ihnen hat ihre eigenen physikalischen Eigenschaften. Zwei seiner genau definierten Formen, Diamant und Graphit, haben eine kristalline Struktur, aber ihre physikalischen Eigenschaften sind unterschiedlich, da auch die Anordnungen der Atome in ihren Strukturen unterschiedlich sind.
+

Quelle: Urheber Pieter Kuiper, Unit cell of the diamond structure, emphasizing tetrahedral units and the face-centered Bravais lattice., Genehmigung Public domain.
Fig. 4. Diamant.
+
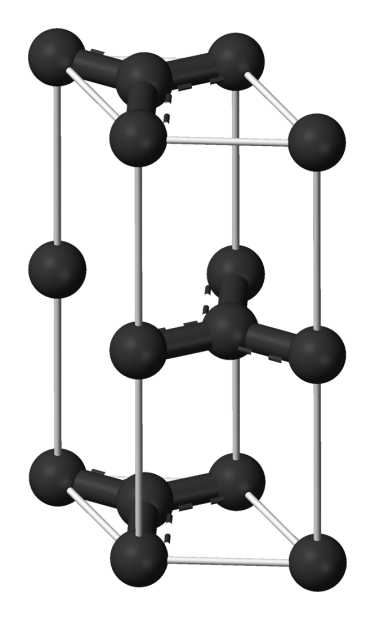
Quelle: Urheber Benjah-bmm27, Graphite-unit-cell-3D-balls, Genehmigung Public domain.
Fig. 5. Graphit.
Kohlendioxid
Kohlendioxid mit der chemischen Formel CO2 ist ein farbloses Gas mit einer Dichte, die etwa 60% höher ist als die von trockener Luft. Kohlendioxid besteht aus einem Kohlenstoffatom und zwei Sauerstoffatomen mit jeweils zwei kovalenten Doppelbindungen. Es kommt natürlich in der Erdatmosphäre vor. Die aktuelle Konzentration beträgt etwa 0,04% Vol. (410 ppm). Sie kommt in natürlichen Quellen wie Vulkanen, heißen Quellen und Geysiren vor und wird durch Auflösen in Wasser und Säuren von Karbonatgesteinen befreit. Es kommt auch natürlich im Grundwasser, in Flüssen und Seen, Eiskappen, Gletschern und Meerwasser vor und ist in Erdöl- und Erdgasvorkommen vorhanden. Karbondioxid ist geruchlos, hat jedoch in hohen Konzentrationen einen scharfen und sauren Geruch.
Atmosphärisches Kohlendioxid ist die primäre Kohlenstoffquelle für das Leben auf der Erde und seine Konzentration wird durch Photosynthese reguliert. Pflanzen und einige Mikroorganismen verwenden Lichtenergie, um Kohlenhydrate aus Kohlendioxid und Wasser zu photosynthetisieren, wobei Sauerstoff als Abfallprodukt entsteht. Es entsteht auch beim Zerfall organischer Stoffe, bei der Fermentation von Zuckern bei der Herstellung von Brot, Bier und Wein sowie bei der Verbrennung von Holz und anderen organischen Stoffen und fossilen Brennstoffen (Kohle, Erdöl und Erdgas).
Es wird auch in vielen Industrieerzeugnissen verwendet, z. B. in Feuerlöschern, Waffen und kohlensäurehaltigen Getränken. Es ist jedoch auch das bedeutende Treibhausgas, da seine Konzentration durch den Einsatz fossiler Brennstoffe und die Entwaldung erhöht wird, was zur globalen Erwärmung führt.
Stickstoff
Stickstoff (Nitrogen) ist das chemische Element mit dem Symbol N und der Ordnungszahl 7. Stickstoff ist das leichteste Mitglied der Gruppe 15 des Periodensystems. Es ist im Universum und im Sonnensystem weit verbreitet. Unter Standardbedingungen liegt es in Form von Distickstoff vor, einem farblosen und geruchlosen zweiatomigen Gas mit der Formel N2. Distickstoff bildet etwa 78% der Erdatmosphäre und ist damit das häufigste nicht kombinierte Element. Stickstoff kommt in allen Organismen vor, in Aminosäuren, Nukleinsäuren (DNA und RNA) und im Energietransfermolekül Adenosintriphosphat. Stickstoff bildet etwa 3% der Körpermasse (er ist das vierthäufigste Element im Körper nach Sauerstoff, Kohlenstoff und Wasserstoff). Der Stickstoffkreislauf beschreibt den Weg des Elements aus der Luft in die Biosphäre und in organische Verbindungen und dann zurück in die Atmosphäre.
Wasser
Wasser mit der chemischen Formel H2O (d.h. jedes seiner Moleküle enthält ein Sauerstoff- und zwei Wasserstoffatome, die durch kovalente Bindungen verbunden sind. Es ist eine polare anorganische Verbindung, die bei Raumtemperatur eine geschmacks- und geruchsneutrale Flüssigkeit ist, die fast farblos mit einem leichten blauen Hauch ist. Das Wasser bewegt sich kontinuierlich durch den Wasserkreislauf von Verdunstung, Transpiration (Evapotranspiration), Kondensation, Niederschlag und Abfluss und erreicht normalerweise das Meer.
Diese einfache Verbindung ist die am meisten untersuchte chemische Verbindung und kann aufgrund ihrer Fähigkeit, viele Substanzen aufzulösen, als ‘universelles ‚Lösungsmittel‘ bezeichnet werden. Dies ist der Grund dafür, dass es das ‚Lösungsmittel des Lebens‘ ist. Es ist die einzige übliche Substanz, die unter normalen Bedingungen auf der Erde als Festkörper (Eis), Flüssigkeit (Wasser, Regen) und Gas (Dampf) vorliegt.

Video 1. Rund um das Wasser.