1.2
Typy nežádoucích účinků
1.2.1
Dělení nežádoucích účinků na základě současných poznatků
- na dávce závislé - typ A (Augmented - zvětšený)
- na dávce nezávislé - typ B (Bizarre - neobvyklý)
- související s délkou léčby - typ C (Continuous - souvislý)
- opožděný - typ D (Delayed - opožděný)
- syndrom z vysazení - typ E (End of use – konec použití)
+
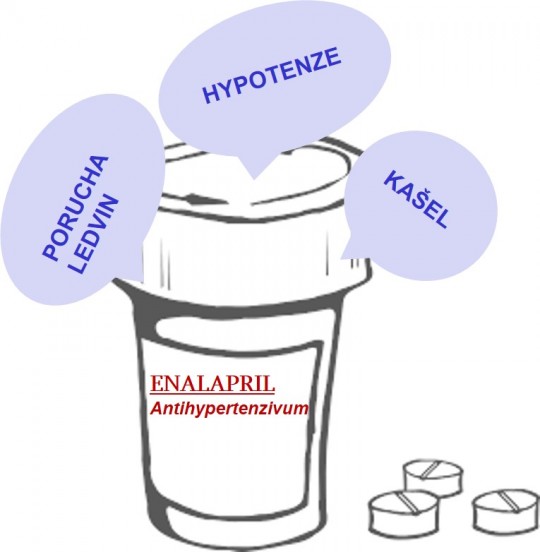
Obr. 4. Enalapril a jeho účinky
1.2.1.1
Typ A – nežádoucí účinky závislé na dávce
Zde jde zpravidla o vystupňování známého, předvídatelného účinku. Tyto NÚ jsou nejčastější. Lze je předvídat, nastanou prakticky u každého pacienta.
Praktický význam mají u rizikovějších typů účinků: například po podání antikoagulancií (snižují krevní srážlivost) vzniká riziko krvácení, po aplikaci inzulinu se může rozvinout hypoglykémie a po antihypertenzivech hypotenze.
1.2.1.2
Typ B – nežádoucí účinky nezávislé na dávce
Tyto účinky jsou nepředvídatelné. Může se jednat buď o alergii, nebo o idiosynkrazii.
Animace 2. Lékové alergie
Léková alergie (hypersensitivní rekce)
Jde o imunologicky zprostředkovanou reakci, kdy léčivo působí jako antigen a vyvolává tvorbu protilátek, které pak navozují nepřiměřenou reakci imunitního systému. Antigeny bývají zpravidla vysokomolekulární látky, což ale většina léčiv nesplňuje. Nicméně nízkomolekulární léčivo (jako tzv. hapten) se v organizmu může navázat na protein (viz obr. 5) - tento komplex organizmus rozpozná jako cizí a při tomto prvním kontaktu s léčivou látkou se imunitní systém senzibilizuje. Druhý kontakt s léčivem pak vede k rychlé tvorbě protilátek a příslušné alergické odpovědi. Zde platí, že i velmi malé dávky léčiva mohou vyvolat bouřlivou odpověď (např. anafylaktický šok).
+
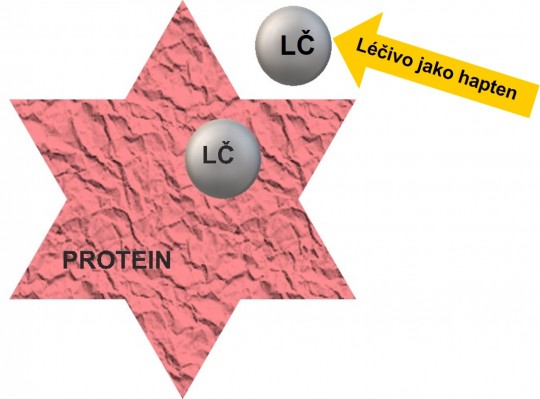
Obr. 5. Nízkomolekulární léčivo navázané na protein spustí v organizmu tvorbu protilátek, popř. senzibilizaci T-lymfocytů
Rozlišují se čtyři typy alergických reakcí:
- Typ I. – anafylaktická reakce
+
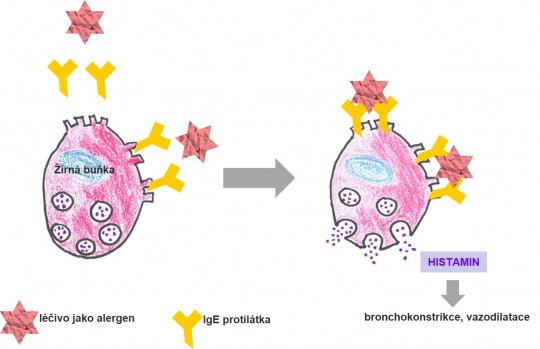
Obr. 6. Anafylaktický šok
- Typ II. - cytotoxická reakce
+
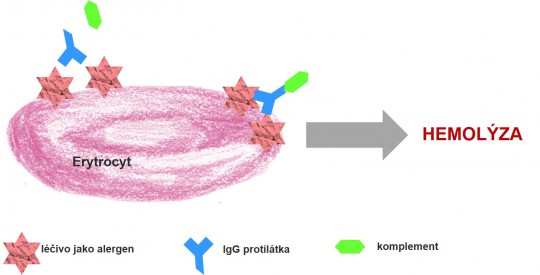
Obr. 7. Cytotoxická reakce
- Typ III. - reakce imunitních komplexů
+
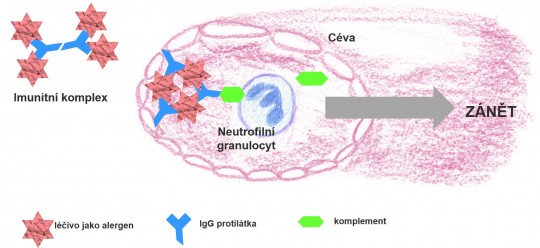
Obr. 8. Reakce imunitních komplexů
- Typ IV. - reakce pozdní přecitlivělosti zprostředkovaná buňkami
+
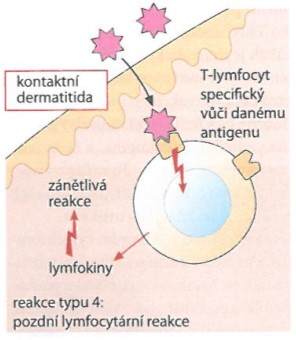
Obr. 9. Reakce pozdní přecitlivělosti
©
Tento obrázek nemůže být z licenčních důvodů začleněn přímo do materiálu. Na obrázek se můžete podívat ZDE.
Obr. 10. Alergická dermatitida
Idiosynkrazie
Idiosynkrazií se označuje geneticky podmíněná abnormální reakce na léčivo (vzniká již po první dávce). Výsledkem je mimořádně vysoká citlivost organizmu na malé dávky nebo mimořádně nízká citlivost na vysoké dávky léčiva. Tento jev se v populaci většinou vyskytuje poměrně zřídka. Podstatou je většinou nízká aktivita enzymů. Poněvadž enzymy jsou bílkoviny, jejichž tvorba je zakódovaná v DNA, genetická výbava organizmu tak působí na léčivo (nikoliv naopak, kdy genom je ovlivněn chemickou látkou, to je účinek mutagenní). Příkladem idiosynkrazie může být acetylační polymorfizmus, kdy se v populaci vyskytují pomalí acetylátoři (u bělochů přibližně 50 %) a rychlí acetylátoři. Může tak být snížen metabolizmus některých léčiv, jako např. antituberkulotika isoniazidu (INH) u pomalých acetylátorů, což vede k jeho vyšším hladinám v plazmě a tedy vyšší toxicitě. Dalším příkladem je nedostatečné odbourávání alkoholu, kdy dochází k hromadění acetaldehydu po požití alkoholických nápojů. Vyskytuje se přibližně u 50 % Asiatů (u bělochů je vzácné).
+
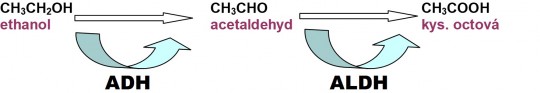
Obr. 11. Metabolizmus ethanolu (ADH = alkoholdehydrogenáza, ALDH = aldehyddehydrogenáza)
1.2.1.3
Typ C – nežádoucí účinky související s délkou léčby
Vznik těchto NÚ závisí jednak na přítomností léčiva v organizmu po delší dobu a dále na celkově podané dávce. Výsledkem je adaptace na přítomnost léčiva, případně chronické poškození organizmu.
- Adaptace se může projevovat jako:
- Chronické poškození organizmu
+
1.2.1.4
Typ D – opožděné nežádoucí účinky
Tento typ nežádoucích účinků se začíná projevovat až po určité době (latenci), např. u karcinogenních účinků to může být např. 20-30 let.
Karcinogenní účinky
Vedou k rozvoji zhoubného bujení (rakoviny), ke vzniku karcinomů (zhoubných nádorů vycházejících z epiteliální tkáně) nebo sarkomů (nádory pojivové tkáně). Nejčastější příčinou bývá poškození DNA.
Proces vzniku rakoviny zahrnuje dvě fáze:
- normální buňka je konvertována na rakovinnou, tzv. „spící buňku“,
- rakovinná buňka se vyvíjí v některou formu nádoru.
Chemické látky vedoucí ke karcinogenezi se nazývají KARCINOGENY.
Karcinogeny se obvykle dělí na:
- genotoxické karcinogeny, které poškozují DNA,
- epigenetické karcinogeny, které samy poškození DNA nenavozují, ale zvyšují pravděpodobnost, že předchozí poškození DNA přejde v karcinogenezi.
Příkladem těchto látek mohou být i některá léčiva - cytostatika (cyklofosfamid, cisplatina), hormonálně působící látky (diethylstilbestrol) nebo produkty plísní (aflatoxiny).
Mutagenní účinky
Jsou způsobeny zásahem cizorodé látky (např. léčiva) do genetického materiálu organizmu (DNA, chromozomů). Podle toho se mutace dělí na:
- genové (bodové), kdy se mění pořadí nukleotidů v řetězci DNA,
- chromozomální (aberace), kdy dochází k přestavbě chromozomů, např. v důsledku zlomů,
- genomové, kdy se mění počty chromozomů. Normální počet u člověka je 46 chromozomů, například při trisomii 21 chromozomu vzniká Downův syndrom.
Mutace v zárodečných buňkách jsou obvykle provázeny zvýšeným výskytem genetických vad v budoucích generacích (= gametické mutace). Mutace v somatických buňkách mohou vést k předčasnému stárnutí nebo vzniku nádorů (= somatické mutace). Přibližně 85 % mutagenů jsou zároveň karcinogeny.
Významný mutagenní potenciál mají některá cytostatika, antivirotika, imunosupresiva, ozón, ionizující záření.
+
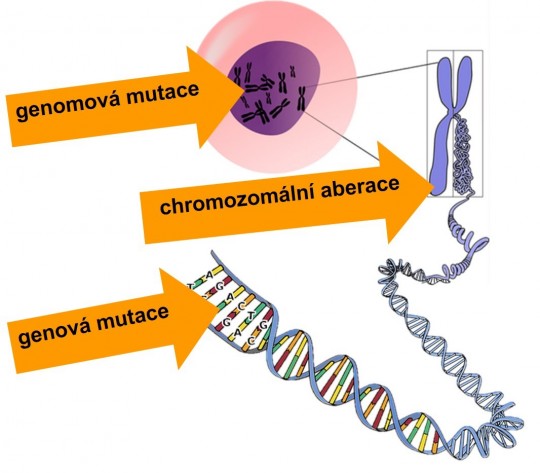
Obr. 13. Mutace
Teratogenní účinky
Jsou to nežádoucí účinky některých léčiv vedoucí k tvorbě vrozených vývojových vad – malformací. Poškození dítěte závisí na tom, v jaké fázi těhotenství lék působí.
- Období blastogeneze, tj. do 17. dne po oplození. Buňky blastocysty nejsou diferencovány, takže při působení teratogenu může dojít buď k rozsáhlému poškození spojenému se zánikem tohoto vývojového stadia, nebo při menším zásahu nepoškozené nediferencované buňky nahradí poškozené a embryo se dále vyvíjí normálně.
+
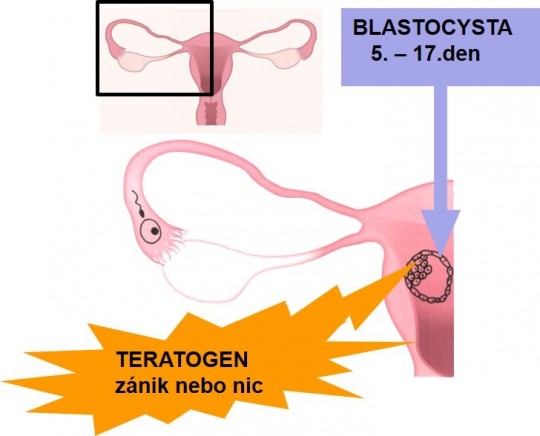
Obr. 14. Zásah teratogenu v období blastogeneze
- Období organogeneze (embryogeneze), tj. od 17. dne do 90. dne, je to nejrizikovější období, protože se vyvíjejí základy orgánů a tak mohou vzniknout velmi těžké vývojové vady (viz dále thalidomid). Zejména v tomto období by se měla žena vyvarovat zbytečného používání léčiv a látek podezřelých z teratogenity.
+
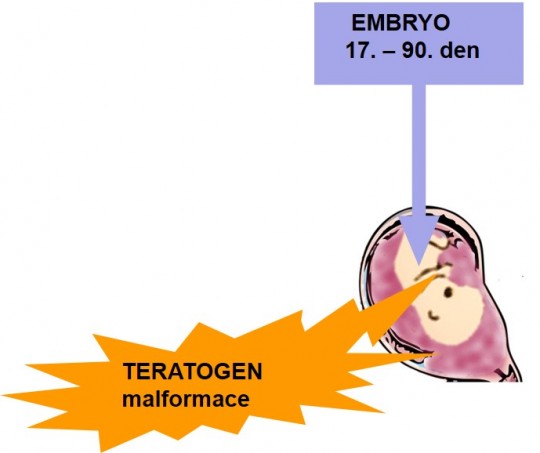
Obr. 15. Zásah teratogenu v období embryogeneze (malformace)
- Období fetální, tj. od 90. do 270. dne, kdy dochází k růstu a zrání plodu (fetu). Vlivem teratogenu mohou vzniknout určité funkční poruchy (nikoliv už hrubé orgánové malformace).
+
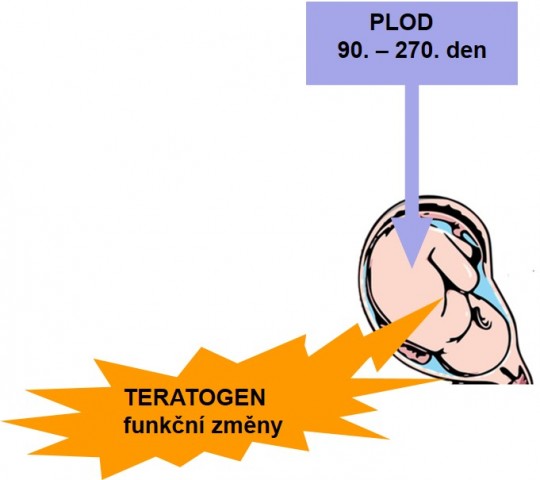
Obr. 16. Zásah teratogenu ve fetálním období
Příklady teratogenů:
- Thalidomid (přípravek CONTERGAN®)
©
Tento obrázek nemůže být z licenčních důvodů začleněn přímo do materiálu. Na obrázek se můžete podívat ZDE.
Obr. 17. Teratogenní účinky thalidomidu
- vysoké dávky vitaminu A, retinoidy mohou způsobit srdeční vady
- glukokortikoidy rozštěpy patra
- mužské hormony defekty zevního genitálu u dívek
- cytostatika rozštěpy patra, defekty nervového systému
- tetracykliny poruchy růstu kostí, hnědé zabarvení skloviny
- ethanol (fetální alkoholový syndrom - FAS) nízkou porodní hmotnost, psychomotorickou retardaci
+
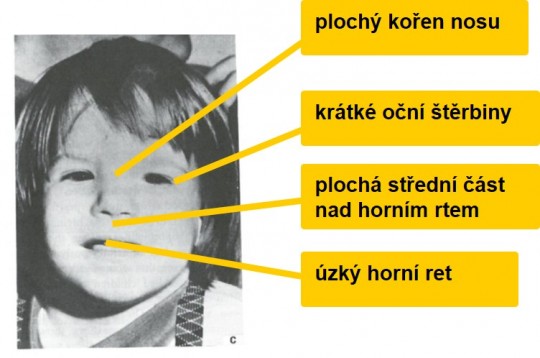
Obr. 18. Fetální alkoholový syndrom
Zajímavost
Nežádoucí účinky se mohou vyskytnout i u kojence, pokud matka užívá léčivo, které v dostatečné koncentraci přestupuje do mateřského mléka.
+
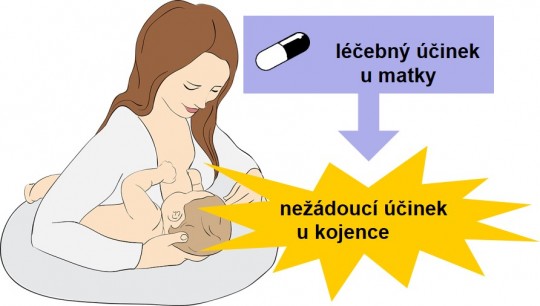
Obr. 19. Nežádoucí účinky u kojence
Například když matka užívá projímadlo s antrachinonovými glykosidy (obsažených v listech senny, aloe), kojenec zpravidla trpí průjmem.
+

Obr. 20. Čaj s obsahem antrachinonových glykosidů
1.2.1.5
Typ E – syndrom z vysazení
Syndrom z vysazení se projevuje buď jako abstinenční syndrom, nebo jako rebound fenomén.
- Abstinenční syndrom
- Rebound fenomén (návratová reakce)
+

Zdroj: Autor rebcenter-moscow, Pixabay.com, licence CC0.
Obr. 21. Nitrožilní aplikace návykové látky