6.4
Zvláštní typy toxických reakcí
Zvláštním typem toxických reakcí jsou kancerogenní a teratogenní účinky. U řady farmak i látek je známo, že mohou vyvolat nádorové onemocnění nebo poškozovat lidský plod. Jako kancerogen se označuje taková chemická látka, která je schopna vyvolat nádorové bujení. Kancerogenita léků je uváděna v informacích o příslušném léku. Významnou roli při vzniku nádorů hraje kouření.
6.4.1
Kancerogenní účinky
Při vzniku chemicky podmíněných nádorů jde o opožděnou reakci tzv. iniciátorů (neúplných kancerogenů), se kterými musí spolupůsobit promotoři. Některé látky jsou tzv. kompletní kancerogeny. V první fázi působí jako iniciátory a ve druhé fázi jako promotory.
Mnoho známých kancerogenů je primárně netoxických, v organismu se transformují z prolátky na účinný kancerogen. Místem zásahu jsou pravděpodobně nukleové kyseliny (NK), kancerogeny reagují s NK nebo reagují s mitochondriemi, uvolní jejich genetický materiál. Kancerogeny působí odstraněním kontroly regulačních genů v buňkách. Chemické kancerogeny (arsen, azbest, benzen, chrom, dehty, yperit, vinylchlorid). Dalším kancerogenem je záření a metabolity buněk vznikající stárnutím.
6.4.2
Teratogenní účinky
Teratogeny jsou ty látky, které mohou vést k malformacím lidského plodu a způsobit vznik vrozených tělesných vad. Zasahují různě při realizaci genetické informace při stavbě orgánů. Výsledkem je ovlivnění biosyntézy, funkce buňky, omezení buněčných pohybů a dělení a zvýšení letality buněk. Většina teratogenů vyvolává změny pouze ve fenotypu (nedědičné změny). Vzácně teratogen vyvolá změny v chromozomální DNA. Může vyvolat defekt ve vývoji tělesného orgánu → dědičné změny. Rozsah a druh poškození ovlivňují vývojová období plodu (doba těhotenství). Též teratogen podaný v různém čase může vyvolat různé typy malformací.
6.4.2.1
Vývojová období plodu
1. období blastogeneze. Blastogeneze probíhá od okamžiku početí až do 17. dne těhotenství. Dochází ke vzniku zygoty, jejímu rýhování v morulu, přeměně moruly v blastocytu, až po diferenciaci zárodečných listů. Časově se jedná o období začínající několik hodin po oplození a trvající až do konce 2. týdne. V tomto období platí princip “všechno nebo nic“ – při větším poškození blastocysta odumře, přičemž dojde ke spontánnímu potratu, anebo poškozenou část nahradí intaktní buňky. Pokud tedy podání léku nezpůsobilo ukončení těhotenství, není další vývoj embrya nepříznivě ovlivněn [5]. Nastávající matka o svém těhotenství ještě neví.
2. období embryogeneze. Kritickým obdobím, v němž řada žen o svém těhotenství ještě neví, je embryogeneze, jež probíhá mezi 19. dnem a 8. týdnem těhotenství. Tehdy se tvoří orgány a orgánové soustavy a napojují se na krevní oběh matky, diferencuje se placenta. V tomto období vznikají rozsáhlé malformace, např. defekty neurální trubice nebo srdeční a cévní anomálie. Škodlivě se zde uplatňují např. alkohol, antikonvulziva (hydantoiny, barbituráty, valproát), deriváty retinolu nebo virové infekce. Je to nejrizikovější období na působení teratogenu.
3. období fetogeneze. Od 9. týdne až do porodu (2. a 3. trimestr) navazuje vývojové stadium fetogeneze. Diferenciace orgánů je ukončena, plod dozrává. V tomto stadiu již obvykle nedochází ke vzniku malformací, ale cytotoxické účinky léků mohou způsobit různé funkční poruchy (např. fetální alkoholový syndrom, deficit inteligence po expozici těžkým kovům, vznik renální insuficience po expozici ACE inhibitorům, nebo behaviorální vady, případně biochemické abnormality [5].
+

Obr. 8. Fotografie krabičky léku s obsahem isotretinoinu s prokázaným teratogenním účinkem
6.4.2.2
Terapeutický versus teratogenní účinek
Těhotná žena užívá léčivo, protože je nemocná. Její choroba může znamenat riziko pro embryofetální vývoj. Pro vyhodnocení četnosti léčivem podmíněných malformací nelze použít kontrolního srovnání se zdravými těhotnými ženami. Kontrolní hodnoty by se musely pořídit u neléčených těhotných žen, což nepřichází v úvahu. Podobné nesnáze při hodnocení případné teratogenity léčiv se vyskytují např. u takových základních onemocnění, jako je diabetes mellitus, hyperthyreóza a jiné hormonální poruchy, hyperemesis gravidarum, epilepsie [5].
Terapie infekcí v těhotenství
Bez nebezpečí pro fétus se mohou podávat peniciliny, cefalosporiny, erytromycin. Krátce před porodem jsou kontraindikovány:
sulfonamidy (nebezpečí jádrového ikteru), chloramphenicol (šedý syndrom).
Relativně kontraindikovaná léčiva: aminoglykozidová antibiotika (poškození sluchu a ledvin u fetu), tetracykliny (ukládání do tvořících se zubů a kostí).
6.4.2.3
Farmakoterapeutické poškození
Prenatální účinky. Poškození, která lze přičíst farmakologickému účinku podaných látek jsou např. krvácení po podání antikoagulanciích, snížená funkce štítné žlázy po léčení matky tyreostatiky, feminizace mužských fetů po podání estrogenů nebo antiandrogenů matce, cytostatika (30 % novorozenců je postiženo malformacemi).
Postnatální účinky. Ani jiná léčiva se pokud možno nemají podávat krátce před termínem porodu. Patří k nim kyselina acetylsalicylová a další nesteroidní analgetika (zpomalení porodu, předčasný uzávěr ductus arteriosus Botalli), opioidy (deprese (deprese dechu u novorozence), benzodiazepiny (poruchy dechu a letargie novorozence), ostatní psychofarmaka (neuroleptika, tymoleptika). Všechny tyto látky lehce prostupují placentární bariérou a působí na CNS novorozence tlumivě, nezralý metabolismus novorozence tyto látky pomalu detoxikuje.
Přenos mateřským mlékem. Řada lipofilních léčiv prostupuje do mateřského mléka a při kojení pak přechází na kojence. Příkladem jsou barbituráty, benzodiazepiny, antrachinonová laxativa, kofein.
Vzhledem k nedostatku spolehlivých znalostí o souvislostech mezi podáváním léčiv v těhotenství a embryotoxickými a teratogenními účinky by se používání farmak během gravidity mělo omezit na minimum. Pokud však těhotná žena trpí onemocněním, které by samo o sobě mohlo ohrožovat embryofetální vývoj, je nutné po zvážení rizika zavést cílenou farmakoterapii. Je třeba mít stále na paměti možnost vzniku poruch. To platí i pro vitalitu novorozenců, kterou může ovlivnit léčení matky v prenatálním období [5].
6.4.2.4
Thalidomidová (Conterganová) aféra
Thalidomid je derivát ftalimidu a kyseliny glutarové, užívaný kolem roku 1960 především v západní Evropě jako hypnotikum (firemní název: Contergan) a také jako léčivo nevolnosti těhotných žen. Následně však bylo zjištěno, že má dalekosáhlé teratogenní účinky. U plodů žen, které užívaly thalidomid v časné fázi těhotenství, se vyskytly četné vrozené vývojové vady (zejména fokomelie), někdy označované jako thalidomidová embryopatie nebo konterganový syndrom. Jedná se zakrnění, případně nepřítomnost horních a dolních končetin [1].
+
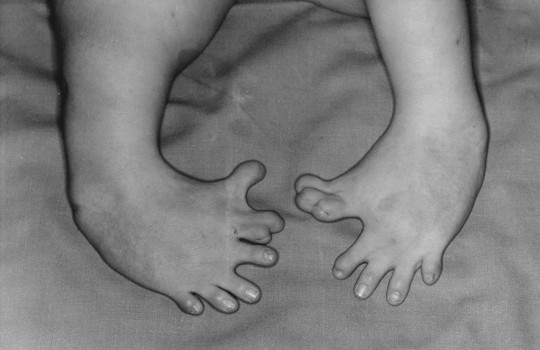
Zdroj: Autor Otis Historical Archives National Museum of Health and Medicine, Congenital malformation of the feet. Effects of maternal drugs - thalidomide. Selected by Tom., licence Creative Commons BY 2.0.
Obr. 9. vrozená fokomelie po thalidomidu
+
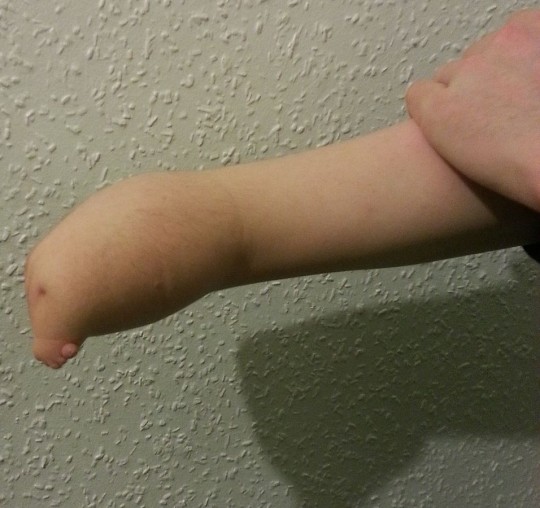
Zdroj: Autor Onearmedbandit86, Photograph of right forearm affected by birth defect Amelia (specifically, Terminal Transverse Hemimelia) in a Caucasian male., licence Creative Commons BY-SA 3.0.
Obr. 10. Fokomelie horní končetina
Chemicky jde o 2-(2,6-dioxo-3-piperidinyl)-1H-isoindol-1,3(2H)-dion. Vyskytuje se ve dvou izomerech S a R.
+
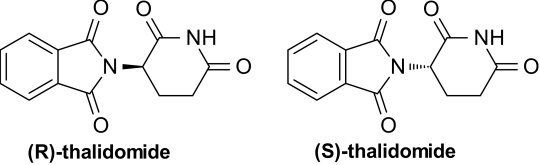
Zdroj: Autor Fuse809, Structure of, licence Public domain.
Obr. 11. Chemická struktura thalidomidu
Použití léku bylo z těchto důvodů zakázáno. Nověji se však prokazuje jeho účinek např. na některé imunitní děje a virové infekce, podává se někdy např. u AIDS a k terapii lepry. Další indikace jsou v hematologii (např. mnohočetný myelom), používá se s imunomodulačními léky [1].