1.3
Modely atomu
První model atomu vytvořil E. Rutherford a nazývá se planetární model. Tato, dnes už překonaná představa stavby atomu, připomíná sluneční soustavu. Uprostřed se nachází kladné jádro, okolo kterého obíhají elektrony po blíže neurčených kružnicích. Planetární model atomu je uveden na obrázku 1. [3]
+
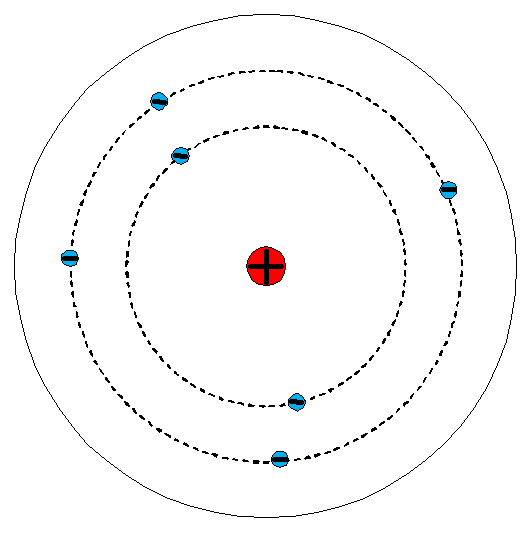
Obr. 1. Planetární model atomu
Novější teorii o stavbě atomu vypracoval N. Bohr. Na základě jeho práce byl později vytvořen kvantově mechanický model, který je znázorněn na obrázku 2. Tento model vychází z kvantové mechaniky, která elektrony popisuje jako částice a současně vlnění. Podle tzv. Heisenbergova principu neurčitosti nelze současně určit, kde se elektrony nacházejí a jakou mají hybnost. Můžeme pouze vypočítat pravděpodobnost, s jakou se elektrony v daném okamžiku vyskytují v určité oblasti atomu. Grafickým vyjádřením této pravděpodobnosti je tzv. orbital, což je oblast s nejhustším výskytem elektronů v elektronovém obalu. [3]
+
Obr. 2. Kvantový model atomu
Orbitaly jsou charakterizovány pomocí 3 kvantových čísel:
- hlavní kvantové číslo n – nabývá hodnot 1, 2, 3,…, místo číslic se používají písmena K, L, M, N,…, udává energii elektronu v atomu,
- vedlejší kvantové číslo l – nabývá hodnot 0, 1, 2,…(n-1), místo číslic se často používají písmena s, p, d a f, udává moment hybnosti elektronu,
- magnetické kvantové číslo m – mění se v rozmezí od –l do +l, udává složku momentu hybnosti elektronu spadající do směru pole, jestliže se atom nachází v magnetickém nebo elektrickém poli, neboli orientaci orbitalu v prostoru. [4]
Existuje také čtvrté kvantové číslo, zvané spinové s, které nabývá hodnot ±1/2 a charakterizuje rotaci elektronu kolem vlastní osy. Toto číslo charakterizuje pouze samotný elektron, nikoliv orbital. [3]
Rozlišujeme orbitaly s, p, d a f. Orbital s je kulově symetrický, orbital p má tvar „přesýpacích hodin“ a 3 možné prostorové orientace. Orbitaly d a f jsou tvarově složitější a d má 5 možných prostorových orientací, orbital f poté celých 7. Grafické znázornění orbitalů s, p, d a f je uvedeno na obrázku 3 a 4. [3]
+
![3. Orbitaly s a p. Zdroj [16].](image/small/img003.png)
Zdroj: Autor haade, Skisser av formene for ett-elektron s, p,d og f orbitaler[3]., licence Creative Commons BY-SA 3.0.
Obr. 3. Orbitaly s a p. Zdroj [16].
+
![4. Orbitaly d a f. Zdroj [16].](image/small/img004.png)
Zdroj: Autor haade, Skisser av formene for ett-elektron s, p,d og f orbitaler[3]., licence Creative Commons BY-SA 3.0.
Obr. 4. Orbitaly d a f. Zdroj [16].
Abychom lépe porozuměli struktuře orbitalu, využíváme tzv. elektronovou konfiguraci, která nám ukazuje obsazení jednotlivých orbitalů elektrony. Elektronová konfigurace se řídí několika základními pravidly:
- Pauliho princip – každý orbital může obsahovat nejvýše 2 elektrony, které se od sebe liší pouze spinovým kvantovým číslem, z čehož plyne, že v atomu nemohou být elektrony, které by měly všechna 4 kvantová čísla stejná,
- výstavbový princip – základní stav atomu je stavem o nejnižší energii, proto elektrony obsazují postupně orbitaly tak, aby měl systém co nejnižší energii,
- Hundovo pravidlo – orbitaly se stejnou energií (tzv. degenerované) se obsazují nejprve po jednom elektronu (se shodným spinovým číslem) a až poté se může doplnit druhý. [4]