2.2
Typy chemických vazeb
2.2.1
Kovalentní vazba
Kovalentní vazba je tvořena sdílením elektronů mezi dvěma atomy. Každý z atomů se na tvorbě vazby podílí svým elektronem či elektrony u násobných vazeb. Oba elektrony mají vždy opačný spin, podle Pauliho principu. [5]
Každý z atomů spojených kovalentní vazbou dosahuje nejstabilnější elektronové konfigurace nejbližšího vzácného plynu. Počet kovalentních vazeb, které vycházejí z atomu prvku ve sloučenině, neboli počet vazebných elektronových párů, které atom sdílí s jinými atomy, se označuje jako vaznost atomu. Pro určení vaznosti prvků 2. a 3. periody se používá tzv. oktetové pravidlo. To nám říká, že atomy vytvářejí tolik vazeb, aby sdílením elektronů dosáhly stabilní konfigurace vzácného plynu. [3]
Pokud se k sobě přiblíží dva atomy při vzniku kovalentní vazby, dochází k průniku jejich valenčních orbitalů a vzniká energeticky výhodnější molekulový orbital. Každý molekulový orbital je charakterizován určitým prostorovým rozložením elektronové hustoty, má určitý tvar. Podle tvaru se rozlišují orbitaly typu σ a π. Po obsazení molekulového orbitalu σ vzniká vazba σ, jejíž elektronová hustota je největší na spojnici jader atomů. Molekulový orbital σ může vzniknout překrytím dvou orbitalů s, s a p nebo s a d, dále dvou orbitalů p nebo p a d, případně dvou orbitalů d. Obsazením molekulového orbitalu π vzniká vazba π, jejíž elektronová hustota je největší mimo spojnici jader atomů, konkrétně v rovině touto spojnicí procházející. Vazba π může vznikat až po vzniku vazby σ a je proto přítomná pouze u násobných vazeb. Vazba π je slabší než vazba σ, takže její přítomnost ve sloučeninách zvyšuje jejich reaktivitu. Molekulový orbital π vzniká překrytím dvou orbitalů p, orbitalů p a d a dvou orbitalů d. [3]
Kovalentní vazbu můžeme dále dělit podle několika kritérií. Prvním kritériem je násobnost vazby. Tady rozlišujeme:
- vazba jednoduchá – dochází ke sdílení jednoho elektronového páru, tvořena vazbou σ, delší a slabší než násobné vazby,
- vazba dvojná – dochází ke sdílení dvou elektronových párů, tvořena vazbami σ a π, kratší a pevnější než jednoduchá vazba,
- vazba trojná – dochází ke sdílení tří elektronových párů, tvořena jednou vazbou σ a dvěma π, nejkratší a nejpevnější. [3]
Grafické znázornění jednoduché, dvojné a trojné kovalentní vazby je uvedeno na obrázku 6.
+
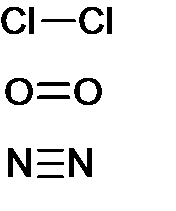
Obr. 6. Jednoduchá, dvojná a trojná kovalentní vazba
Dalším kritériem, podle kterého dělíme kovalentní vazbu, je její polarita. Tato vlastnost je zásadní pro pochopení vlastností chemických sloučenin. Abychom porozuměli následujícímu dělení, je potřeba definovat pojem elektronegativita. Jedná se o významnou vlastnost atomů, označuje se X. Jedná se o schopnost atomů přitahovat k sobě vazebné elektrony, tj. elektrony účastnící se chemické vazby. Pomocí rozdílu elektronegativit atomů, mezi kterými je vytvořena kovalentní vazba, rozlišujeme:
- kovalentní nepolární vazba – vzniká mezi dvěma stejnými atomy nebo atomy jejichž rozdíl elektronegativit je menší než 0,4; rozdělení elektronové hustoty mezi oběma atomy je rovnoměrné, protože oba atomy přitahují vazebné elektrony zhruba stejnou silou,
- kovalentní polární vazba – vzniká mezi dvěma atomy, jejichž rozdíl elektronegativit je v rozmezí 0,4 a 1,7; atom s vyšší elektronegativitou k sobě přitahuje vazebné elektrony a vzniká na něm částečný záporný náboj (δ-), naopak na druhém atomu vzniká částečný kladný náboj (δ+); molekula má ve výsledku dva různě nabité póly, tvoří tzv. dipól,
- iontová vazba – jedná se o extrémní případ polární kovalentní vazby, kdy je rozdíl elektronegativit mezi dvěma atomy vyšší než 1,7; elektronegativnější atom si kompletně přitáhne vazebné elektrony, takže ve finále dochází ke vzniku iontů (kladného kationtu a záporného aniontu). [3]
Grafické znázornění nepolární, polární a iontové kovalentní vazby je uvedeno na obrázku 7.
©
Tento obrázek nemůže být z licenčních důvodů začleněn přímo do materiálu. Na obrázek se můžete podívat ZDE.
Obr. 7. Polární, nepolární a iontová kovalentní vazba
2.2.2
Koordinačně-kovalentní vazba
Koordinačně-kovalentní či jen koordinační vazba je zvláštním typem vazby kovalentní. Vyznačuje se tím, že oba elektrony, které zprostředkovávají vazbu, jsou poskytovány pouze jedním z atomů. Tato situace může nastat pouze tehdy, když tento atom obsahuje nevazebný elektronový pár, tj. pár valenčních elektronů, které dosud nejsou zapojené do žádné vazby. Atom, který poskytuje elektronový pár, se označuje jako donor neboli dárce. Druhý atom, který elektronový pár přijímá, je akceptor neboli příjemce. Tento druhý atom musí mít k dispozici volný orbital, do kterého může elektronový pár navázat. Z tohoto důvodu bývá koordinační vazba někdy označována jako donor-akceptorová. Koordinační vazbu nalezneme u koordinačních (komplexních) sloučenin. Tato skupina sloučenin se zapisuje do hranatých závorek a má své specifické názvosloví. [4]
2.2.3
Kovová vazba
Kovy a nekovy se od sebe výrazně liší v mnoha různých vlastnostech. Abychom lépe pochopili vlastnosti kovových prvků, bylo potřeba vytvořit zvláštní představu kovové vazby. V krystalu kovu se nacházejí pravidelně uspořádané kationty kovu, které jsou obklopené delokalizovanými elektrony uvolněnými z atomů. Kovové krystaly mohou tvořit pouze atomy s poměrně malou ionizační energií. Jednotlivé kationty jsou drženy u sebe pomocí delokalizovaných elektronů, které jsou volně pohyblivé a přesouvají se v rámci krystalu vlivem vloženého potenciálového spádu. [5]
Kovová vazba má vzhledem k nedostatku elektronů zcela zvláštní charakter. V krystalech kovů nemůže existovat nic, co by se podobalo individuálním vazbám. Molekulové orbitaly se mohou vytvořit pouze pro krystal jako celek. Tyto závěry vedou k představě tzv. energetických pásů. Představa energetických pásů není jen teoretická, ale opírá se o výsledky studia rentgenových spekter. [5]
Výše popsaná představa kovové vazby nám umožňuje uspokojivě vysvětlit charakteristické vlastnosti kovů. Jejich hlavním fyzikálním znakem je dobrá elektrická vodivost, která je nepřímo úměrná teplotě a je výrazně zhoršována nečistotami. Za běžných podmínek se v krystalu pohybuje stejný počet elektronů v každém směru. Pokud je zvnějšku vložen potenciálový spád, elektrony se začnou pohybovat přednostně v jednom směru a krystalem začne procházet elektrický proud. Tento pohyb elektronů uvnitř tzv. vodivostního pásu je podstatou elektrické vodivosti kovů. Mohli bychom očekávat, že zvýšením teploty dojde k vybuzení většího počtu elektronů do vodivostního pásu, čímž se zvýší vodivost celého kovu. Ve skutečnosti ale vodivost s teplotou klesá, neboť při vyšší teplotě vzrůstají tepelné vibrace krystalu, jimiž je narušováno pravidelné uspořádání atomů v krystalu a tím dochází k zabránění pohybu elektronů. Stejně fungují i nečistoty uvnitř krystalu, které taktéž naruší pravidelné rozložení atomů. [5]
Mezi další vlastnosti charakteristické pro kov, které můžeme vysvětlit pomocí výše uvedené představy kovové vazby, patří např. tepelná vodivost či lesk. Tepelnou vodivost můžeme vysvětlit tak, že při absorpci tepelné energie krystalem kovu na jednom místě, dochází pomocí pohyblivých elektronů snadno k přenosu na místo jiné. Lesk kovů také můžeme snadno odůvodnit. Elektrony v kovových krystalech absorbují energii dopadajícího záření a dochází k excitaci do vyšších hladin energetického pásu. Při návratu na původní hladinu energie poté dochází k emitaci záření o stejné vlnové délce. Tím je vysvětlena také neprůhlednost kovů, neboť ani velmi tenkou fólií kovu neprochází žádné světlo. [5]