5.3
Skupiny uhlovodíků
5.3.1
Alkany a cykloalkany
Jako alkany a cykloalkany označujeme uhlovodíky, které obsahují pouze jednoduché vazby. Jedná se o uhlovodíky nasycené. Cykloalkany mají cyklickou strukturu. [1]
Alkany a cykloalkany tvoří homologickou řadu. Obecný vzorec je CnH2n+2. Historicky byly označovány jako parafíny („parum affinis“ = malá slučivost). [6]
5.3.1.1
Stereochemie
V kapitole 2 byla podrobně popsána stereochemie alkanů a cykloalkanů. Připomeňme si zákrytovou a nezákrytovou konformaci ethanu (obrázek 6) a vaničkovou a židličkovou konformaci cyklohexanu (obrázek 7).
Množství možných konformací a jejich složitost roste s délkou uhlíkového řetězce alkanu. Důvodem je možnost rotace skupin kolem jednoduché kovalentní vazby. Jako příklad uvedeme butan a možné konformace při rotaci vazby mezi druhým a třetím uhlíkem. Konformace zde mohou být tzv. antiperiplanární, synklinální nebo synperiplanární. Detailní struktura vyšších uhlovodíků je již tematicky nad rámec tohoto materiálu. [2]
5.3.1.2
Fyzikální vlastnosti
Alkany od C1 do C4 jsou plynné látky, od C5 do C15 kapaliny a C16 a vyšší pevné látky. Vyskytují se v zemním plynu a ropě. Jedná se o bezbarvé látky, rozpustné v organických rozpouštědlech. Cykloalkany mají obdobné fyzikální vlastnosti jako alkany. [6]
V homologické řadě, kde každý další uhlovodík obsahuje navíc skupinu –CH2–, se dají pozorovat určité zákonitosti měnících se vlastností. V řadě např. stoupá bod varu s rostoucí relativní molekulovou hmotností sloučeniny. To je dáno velikostí vlivu van der Waalsových přitažlivých mezimolekulárních sil. Čím větší je molekula, tím více se tyto síly projevují a tím více energie je potřeba dodat, aby se molekuly oddálily a došlo ke změně skupenství z kapalného na plynné. Krom toho je bod varu závislý také na tvaru molekuly. Čím více jsou molekuly rozvětvené, tím méně se uplatňují van der Waalsovy síly, takže větvenější alkany mají nižší body varu než nevětvené. [3]
5.3.1.3
Chemické vlastnosti
Alkany a cykloalkany jsou díky své vysoké stabilitě málo reaktivní. Přesto některým reakcím podléhají. Typická je pro ně radikálová substituce. Při této reakci musí být nejprve připraven radikál, který má výrazně vyšší reaktivitu. Reakční mechanismus radikálové substituce byl podrobně popsán v kapitole 4.3.6.1. Alkany nejčastěji reagují s radikálem halogenu, reakce se označuje jako halogenace. Vznikající halogenderiváty jsou významné průmyslové suroviny.
Dalším typem reakce, kterému alkany podléhají, je oxidace. Jedná se o prudkou reakci s kyslíkem, jinak řečeno hoření. Při kompletní oxidaci organických látek vzniká oxid uhličitý a voda, což je patrné na následující rovnici:
CH4 + 2 O2 → CO2 + 2 H2O
Alkany mohou také odštěpováním vodíku (tzv. dehydrogenací) tvořit nenasycené uhlovodíky. Příkladem může být vznik ethenu z ethanu. Rovnice je uvedena zde: [6]
C2H6 → H2 + C2H4
Na závěr zmíníme tzv. sulfochloraci. Jde o reakci, která probíhá radikálovým mechanismem. Alkany reagují se sulfurylchloridem za přítomnosti ultrafialového záření a vznikají alkansulfurylchloridy. Tyto produkty se mohou posléze hydrolyzovat na alkylsulfonové kyseliny, které slouží k výrobě čisticích prostředků (tzv. detergentů). [3]
5.3.1.4
Zástupci
- Methan CH4
Jedná se o bezbarvý plyn, který je hlavní součástí zemního plynu (může tvořit až 99 %). V přírodě vzniká rozkladem celulosy, proto se někdy označuje jako bahenní plyn. Říká se mu také důlní plyn, protože se hromadí v uhelné hmotě a okolních horninách. Jeho směs se vzduchem je po zapálení výbušná. Využívá se k výrobě vodíku, sazí, syntézního plynu (směs vodíku a oxidu uhelnatého) a dalších organických látek.
- Ethan C2H6
Jedná se o plynný uhlovodík doprovázející methan. Využívá se k výrobě ethenu.
- Propan C3H8 a butan C4H10
Tyto dva plyny jsou součástí zemního plynu a využíváme je jako náplň do vařičů.
- Cyklohexan C6H12
Tento cyklický alkan je za normálních podmínek kapalina a využívá se převážně jako rozpouštědlo. [6]
5.3.2
Alkeny, cykloalkeny a polyeny
Jedná se uhlovodíky obsahující alespoň jednu dvojnou vazbu (alkeny), případně s cyklickou strukturou (cykloalkeny) nebo látky s několika dvojnými vazbami (polyeny). Z polyenů jsou nejvýznamnější dieny, které mají ve své molekule dvě dvojné vazby. Obecný vzorec alkenů je CnH2n. Tvoří homologickou řadu obdobně jako alkany. Historicky se nazývaly olefiny. [1]
5.3.2.1
Stereochemie
Z hlediska struktury je u alkenů nejvýznamnější izomerie cis-trans ((E)-, (Z)-). O této problematice je pojednáno v kapitole 2.3.1.
U polyenů se musíme zmínit o rozmístění dvojných vazeb v molekule. Existuje několik možností, jak může být větší množství dvojných vazeb v molekule umístěno. Rozlišujeme dvojné vazby kumulované (blízko sebe), izolované (daleko od sebe) a konjugované (střídání jednoduché a dvojné vazby). Konjugované systémy mají velký význam i u složitějších organických látek, kde tvoří např. chromofor u karotenů. [3]
5.3.2.2
Fyzikální vlastnosti
Svými fyzikálními vlastnostmi jsou tyto sloučeniny velmi podobné alkanům. Nejnižší jsou opět plyny, vyšší kapaliny a nejvyšší pevné látky. Jsou součástí zemního plynu. Průmyslově jsou velmi významné, neboť několik zástupců se využívá k výrobě běžně užívaných plastů. [6]
5.3.2.3
Chemické vlastnosti
Chemickými vlastnostmi se alkeny výrazně liší od alkanů. Důvodem je přítomnost násobné vazby v jejich molekule. Dvojná kovalentní vazba je tvořena jednou vazbou σ a jednou vazbou π. Právě elektrony tvořící π vazbu snadno vstupují do chemických interakcí a udávají tak vyšší reaktivitu alkenů v porovnání s alkany a také předurčují typickou reakci alkenů, což je adice. [1]
Jak již bylo řečeno, typickou reakcí alkenů je adice, a to konkrétně elektrofilní. Podrobný mechanismus adice byl popsán v kapitole 4.3.6.1. Zde pouze připomeneme, že se jedná o reakci s dvojnou vazbou, která se mění na vazbu jednoduchou a jiné atomy nebo skupiny se váží na uhlíky, mezi kterými násobná vazba původně byla přítomna. Konkrétně sem můžeme zařadit hydrogenaci (navázání vodíku), hydrohalogenaci (navázání halogenvodíku) nebo halogenaci (navázání halogenu). Při reakcích se uplatňuje induktivní efekt (kapitola 4.5) a Markovnikovo pravidlo (kapitola 4.3.6.1). Průběh hydrogenace nejjednoduššího alkenu (ethenu) je uveden na obrázku 15. [6]
+
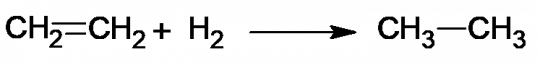
Obr. 15. Hydrogenace ethenu
Co se týče adice vody (hydratace), tak ta neprobíhá přímo, ale lze ji uskutečnit nepřímo adicí kyseliny sírové a hydrolýzou vznikající kyseliny alkylsírové. Vzniká nakonec příslušný alkohol ve shodě s Markovnikovovým pravidlem. [3]
Můžeme zmínit ještě ozonolýzu a epoxdiaci. Ozonolýza je reakce, při které na dvojnou vazbu působí ozón a vznikají ozonidy přes meziprodukty, tzv. molozonidy. Ozonidy dále hydrolyzují vodou nebo se štěpí vodíkem na karbonylové sloučeniny. Epoxidace je reakce, kdy působí peroxokyseliny na alkeny a vznikají epoxidy, které lze hydrolýzou převést na dioly. [3]
Další zajímavou reakcí, které alkeny podléhají, je polymerace. Jedná se vlastně o mnohokrát opakovanou adici, při které vznikají tzv. polymery. Jelikož polymery jsou v tomto materiálu podrobně popsány v samostatné kapitole 7, nebudeme se touto reakcí nyní zabývat.
5.3.2.4
Zástupci
- Ethen C2H4
Jedná se nasládlý, bezbarvý plyn, který byl dříve označován jako ethylen. Se vzduchem vytváří výbušnou směs. Využívá se na výrobu polyethylenu (PE), ethanolu, a mnoha dalších velmi významných organických sloučenin. Je to také nejjednodušší rostlinný hormon, který ovlivňuje zrání ovoce, odbourávání chlorofylu a opadávání listů a květů.
- Propen C3H6
Dříve byl označovaný jako propylen. Je to plynný uhlovodík a využívá se na výrobu polypropylenu (PP), acetonu a dalších organických látek.
- But – 1,3 – dien
Tento dien se využívá na výrobu syntetického kaučuku.
- 2 – methylbut – 1,3 – dien
Jedná se o dien, který se triviálně označuje jako isopren. Je to základní stavební jednotka isoprenoidů (terpeny). Využívá se na výrobu kaučuků. Vzorce obou jmenovaných dienů jsou uvedeny na obrázku 16. [3]
+

Obr. 16. Vzorec but-1,3-dienu a 2-methylbut-1,3-dienu
5.3.3
Alkyny
Jedná se o uhlovodíky obsahující jednu trojnou vazbu. Historicky byly označovány jako acetyleny podle nejjednoduššího zástupce. Jejich obecný vzorec je CnH2n-2. Tvoří homologickou řadu stejně jako alkany a alkeny. Trojná vazba je složena z jedné vazby σ a dvou vazeb π a je kratší než dvojná. Přítomnost trojné vazby udává chemické vlastnosti této skupiny uhlovodíků. [3]
5.3.3.1
Stereochemie
Přítomnost trojné vazby v molekule alkynů se projevuje tak, že sousední uhlíkové atomy leží v jedné přímce s trojně vázanými atomy. Z tohoto důvodu je vyloučena možnost existence cykloalkynů s cyklem menším než osmičlenným. Vzdálenost uhlíků, mezi kterými je trojná vazba, je kratší než u jednoduché i dvojné vazby. [1]
5.3.3.2
Fyzikální vlastnosti
Fyzikální vlastnosti alkynů jsou podobné jako u alkanů a alkenů. Mají však vyšší teploty varu než ostatní uhlovodíky. [3]
5.3.3.3
Chemické vlastnosti
Typická reakce alkynů je adice. Elektrofilní činidla jsou adována méně ochotně než nukleofilní. Alkeny podléhají např. hydrataci (adici vody), halogenaci (adici halogenu) a hydrogenaci (adici vodíku). Při hydrogenaci mohou vznikat alkeny i alkany. Hydratace nejjednoduššího alkynu, tedy ethynu, probíhá v přítomnosti rtuťnatých solí a vzniká nejprve vinylalkohol, který se okamžitě mění na stabilnější acetaldehyd. [3]
Další reakcí alkynů může být oxidace, která se provádí koncentrovaným roztokem manganistanu draselného. Produkty jsou stejné jako u alkenů, a to příslušné karboxylové kyseliny. [3]
5.3.3.4
Zástupci
- Ethyn C2H2
Jedná se o plyn bez barvy a zápachu. Historicky se mu říkalo acetylen. Ve směsi se vzduchem může dojít k explozi. Ve směsi s kyslíkem se využívá při autogenním sváření. Je to surovina pro výrobu dalších organických látek, hlavně halogenderivátů uhlovodíků, kyseliny akrylové nebo vinylchloridu. Vyrábí se např. hydrolýzou karbidu vápníku (lze jej získat tavením koksu v přítomnosti oxidu vápenatého) nebo parciální oxidací či pyrolýzou methanu.
- Vinylethyn CH≡CCH=CH2
Tato sloučenina se využívá na výrobu chloroprenového kaučuku. [3]
5.3.4
Areny
Areny jsou aromatické uhlovodíky. Jedná se o velmi specifickou skupinu uhlovodíků. Nejjednodušším zástupcem je benzen. Areny mají tzv. aromatické jádro (benzenové jádro nebo kruh). Každá aromatická sloučenina musí splňovat několik základních podmínek, aby mohla být řazena k arenům. První z nich je, že molekula musí být cyklická a atomy, které cyklus tvoří, musí ležet v jedné rovině. Další podmínkou je, že uvnitř cyklu dochází ke střídání jednoduché a dvojné vazby, ve skutečnosti jsou elektrony z dvojných vazeb tzv. delokalizované. Delokalizaci elektronů zakreslujeme jako kruh. Poslední podmínkou je, že celkový počet π elektronů (včetně volných elektronových párů) musí vyhovovat Hückelovu pravidlu, podle kterého je tento počet roven 4n + 2 (n je nula nebo celé, kladné číslo). [3]
5.3.4.1
Stereochemie
Systém střídající se jednoduché a dvojné vazby je opravdu konjugovaný pouze tehdy, když je jeho geometrické uspořádání takové, že elektrony π jsou v dokonalé interakci. Tato podmínka je splněna tehdy, když jsou všechny vazby σ planární, neboli v jedné rovině. Když se podíváme detailně na molekulu benzenu, zjistíme, že všechny atomy uhlíku leží v jedné rovině a vytvářejí pravidelný šestiúhelník. Šest atomů uhlíku a šest atomů vodíku jsou spolu spojeny pomocí vazeb σ. Zbývajících šest elektronů z p orbitalů se rozprostírají nad a pod rovinu kruhu. Měření prokázala, že v benzenu jsou všechny vazby stejně dlouhé a jejich délka odpovídá střední hodnotě mezi délkou jednoduché a dvojné vazby. Struktura benzenu je uvedena na obrázku 17. [1]
+
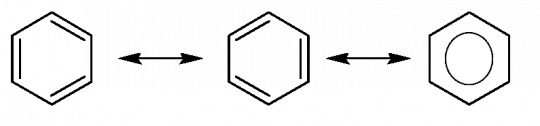
Obr. 17. Struktura benzenu
5.3.4.2
Fyzikální vlastnosti
Z fyzikálního hlediska jsou aromatické uhlovodíky kapaliny nebo pevné látky. Nejdůležitější suroviny, ze kterých se získávají, je černouhelný dehet nebo ropa. Dehet se získává karbonizací uhlí spolu s koksem a svítiplynem. Často jsou doprovázeny heterocyklickými sloučeninami.
Jedná se o látky s typickým zápachem, které jsou často jedovaté, karcinogenní (způsobují rakovinu) či mutagenní (způsobují mutace). Jsou špatně rozpustné ve vodě, ale výborně rozpustné v nepolárních rozpouštědlech. [3]
5.3.4.3
Chemické vlastnosti
Typickou reakcí je elektrofilní substituce jádra. Potřebné elektrofilní činidlo (s nedostatkem elektronů) vzniká během reakce. Příkladem může být nitrace benzenu. Prvním stupněm je protonace kyseliny dusičné a rozklad vzniklého kationtu za tvorby nitroniového kationtu a vody. Nitroniový kation poté napadá benzenové jádro za vzniku komplexu π. Tento komplex se poté mění na komplex σ, ve kterém je již skupina -NO2 navázána na jeden z uhlíkových atomů kruhu. Tím dochází k porušení aromatického uspořádání. Díky přítomnosti kyseliny sírové následně dochází k rearomatizaci kruhu a vzniká nitrobenzen. Průběh nitrace benzenu je uveden na obrázku 18. [5]
+
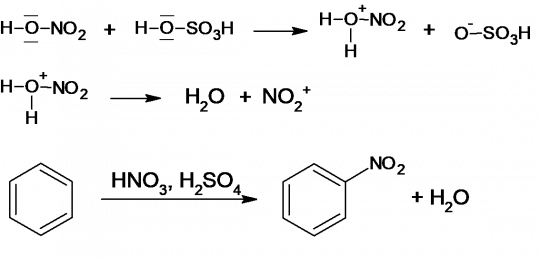
Obr. 18. Nitrace benzenu
Za vhodných podmínek může z benzenu vznikat elektrofilní substitucí několik produktů, které se liší počtem navázaných substituentů. O místě navázání druhého a dalších substituentů rozhoduje druh substituentu, který byl na jádře navázán jako první. Alkylové skupiny a skupiny, které obsahují volné elektronové páry (např. hydroxylová skupina, aminoskupina nebo halogeny) řídí vstup dalšího substituentu do poloh ortho- nebo para-. Tyto substituenty označujeme jako „substituenty prvního řádu“. Skupiny, které mají naopak elektronový deficit (např. nitroskupina, karboxylová skupina) řídí vstup dalších substituentů do polohy meta-. Pokud chceme v názvu vznikajícího produktu vyjádřit postavení skupiny na aromatickém kruhu, používáme před názvem derivátu předpony o-, p- a m-. [5]
Kromě substituce může u aromatických uhlovodíků probíhat také oxidace (hoření) nebo adice. Zde můžeme zmínit adici chloru na benzen za vysoké teploty a ozáření za vzniku hexachlorcyklohexanu nebo hydrogenaci probíhající za přítomnosti katalyzátoru, při které vzniká cyklohexan. [5]
5.3.4.4
Zástupci
- Benzen C6H6
Jedná se o bezbarvou, hořlavou a jedovatou kapalinu. Je znám již od roku 1825, kdy byl zjištěn v plynu získaném karbonizací černého uhlí. Je to často užívané rozpouštědlo a také výchozí surovina pro výrobu mnoha dalších organických sloučenin, např. styrenu, fenolu nebo anilinu.
- Toluen (methylbenzen) C6H5CH3
Toluen je látka svými vlastnostmi podobná benzenu. Používá se také jako rozpouštědlo a má velmi specifický zápach. Jeho oxidací se může získat kyselina benzoová. V průmyslu je využíván k výrobě trinitrotoluenu (TNT), což je látka známá pro své využití jako výbušnina. Toluen bývá zneužíván jako inhalační droga.
- Styren (vinylbenzen) C6H5CH=CH2
Tato látka se připravuje katalytickou dehydrogenací ethylbenzenu. Jeho polymerací vzniká polystyren (PS), což je polymer využívaný především na výrobu obalového materiálu.
- Naftalen C10H8
Naftalen je bílá krystalická látka, která snadno sublimuje již za běžné teploty. Je to také surovina pro výrobu mnoha organických sloučenin (např. azobarviv, kyseliny ftalové a dalších).
- Anthracen a fenanthren C14H10
Tyto dva izomerní tricyklické uhlovodíky jsou základní strukturou některých složitějších organických látek, např. strukturu fenanthrenu v sobě obsahuje molekula cholesterolu a mnoho látek od něj odvozených. [3]