- kapilární (arterializované)
- venózní
- arteriální (provádí lékař)
Ad. a) vpichem do prstu, ušního lalůčku, u kojenců z paty
- místo vpichu nahřejeme a vydezinfikujeme, dezinfekční prostředek necháme zaschnout, aby nedošlo k hemolýze
- vpich provádíme z boku bříška prstu (nikoliv ze středu bříška), 1. kapku otřeme, 2. kapku necháme nasát do kapiláry
+
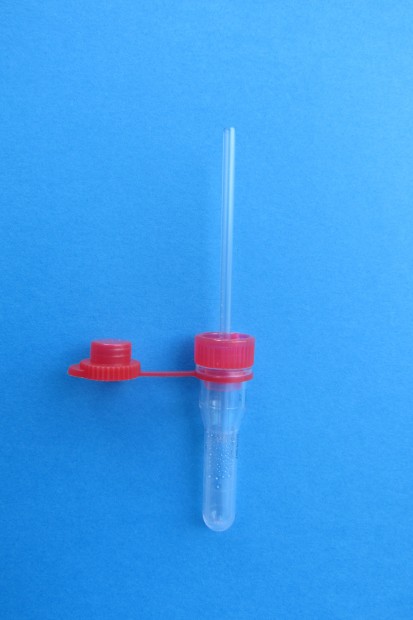
Obr. 3. Odběrová zkumavka s kapilárou
- na prst příliš netlačíme, aby se nezvyšovalo množství tkáňového moku v kapce krve
- provedeme dezinfekci rány
Poznámka
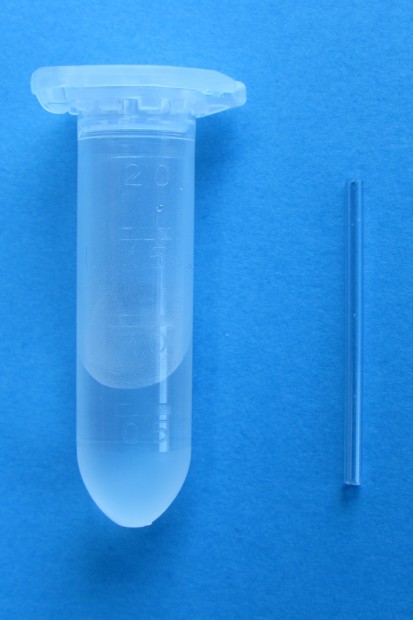
Pozor! Aby v kapiláře nevznikly bublinky, nasaje se jen trochu krve. Pak dochází k samovolnému nasávání. Kapiláry mají vnitřní stěny pokryty vysušeným antikoagulačním prostředkem (většinou heparinem), proto ihned po odběru krve na vyšetření ABR uzavřeme jeden konec kapiláry čepičkou, vložíme ocelový drátek, uzavřeme druhý konec čepičkou a ihned pečlivě promícháme krev s antikoagulačním prostředkem pomocí magnetu.
+

Obr. 4. Kapilára pro odběr krve na stanovení ABR
Krev na vyšetření glukózy se odebírá do zkumavky Eppendorf s EDTA a NaF, a to pomocí kalibrované kapilárky o objemu 20 µl. Po naplnění se celá kapilárka vloží do zkumavky Eppendorf s 1ml hemolyzačního roztoku. Po uzavření se důkladně protřepe, aby krev z kapilárky vytekla do roztoku.
+
Obr. 5. Zkumavka Eppendorf s EDTA a NaF a kalibrovaná kapilárka
Ad. b) ze žíly v loketní jamce nebo z předloktí, ze žil na zápěstí, u kojenců ze spánkových žil
- mírně stáhneme paži elastickým turniketem (necvičit, aby nenastala zástava krve v paži, stažení by nemělo být delší než 1 minutu), u lidí s dobře viditelnými žilami je vhodné provádět odběr z nezatažené paže
- posoudíme kvalitu žilního systému a vybereme místo vpichu
- vydezinfikujeme místo vpichu, dezinfekční prostředek necháme zaschnout (další palpační vyhledávání žíly pro vpich po použití dezinfekce je nepřípustné)
- nabodneme žílu, turniket uvolníme a krev vypouštíme volně do zkumavky nebo odebíráme do stříkačky (krev musí být nasávána pomalu a pomalu i vyprazdňována ze stříkačky, nesmí pěnit!)
- po odběru ošetříme místo vpichu sterilním tamponem a tlačíme na ně po dobu 3 – 5 minut (někdy i déle)
Pracovní postup při použití odběrového vakuového uzavřeného systému [1]:
Zdroj: Prof. MUDr. Jaroslav Racek, DrSc., VOV Z188/01 – Odběr žilní krve uzavřeným vakuovým systémem, licence Creative Commons BY 3.0.
Video 1. Odběr žilní krve uzavřeným vakuovým systémem
- dobře upevníme vhodnou odběrovou jehlu v aplikátoru (držáku jehly)
- použijeme jednorázové ochranné rukavice
- uchopíme pevně pacientovu paži
- palcem přimáčkneme žílu cca 2 – 5 cm pod místem vpichu (tzv. zafixujeme žílu)
- provedeme venepunkci, při neúspěchu venepunkce je nutné vždy provést výměnu jehly
- uchopíme pevně a bez pohybu aplikátor, zatlačíme zkumavku až na doraz
- udržujeme zkumavku pod místem vpichu
- sejmeme turniket, jakmile se objeví první krev ve zkumavce (maximálně do jedné minuty)
- během odběru se snažíme maximálně zamezit pohybu zkumavky
- zachováváme konstantní tlak na konec zkumavky ve směru jehly
- naplníme zkumavku až do doby vyrovnání tlaku (podtlak je vypočítán na objem potřebný pro správný poměr krve a případného aditiva, zkumavka je též označena ryskou pro požadovaný objem vzorku)
- když krev přestane téct, vyjmeme zkumavku z aplikátoru (gumová chlopeň zamezí výtoku krve, dokud nevložíme další zkumavku)
- zkumavku ihned po odběru asi 8x jemně převrátíme (netřepat!!!)
- vložíme do aplikátoru případnou další zkumavku
- místo vpichu i s jehlou zakryjeme sterilním krytím
- na sterilní tampon jemně zatlačíme a pomalým tahem odstraníme jehlu ze žíly tak, aby nedošlo k poranění žilní stěny
- očistíme místo odběru sterilním tamponem a provedeme jeho sterilní zakrytí
Obecné zásady odběru krve:
- odběr provádíme zpravidla ráno (mezi 6. až 8. h), nalačno (ráno před odběrem by pacient neměl pít kávu, alkoholické nápoje a kouřit, ráno před odběrem se musí napít vody či hořkého čaje, aby nebyl dehydratován), odpoledne a večer před odběrem by neměl jíst tučná jídla a neměl by trpět žízní, pacient by se měl 24 hodin vyvarovat neobvyklé tělesné námahy a 30 minut před odběrem by měl být v klidu
- pacient by měl během odběru sedět nebo ležet (vstoje koncentrace některých analytů stoupají, imobilizace naopak způsobuje snížení koncentrace bílkovin)
- jehly musí být dostatečného průměru, jinak může dojít k prasknutí membrány erytrocytu (hemolýza)
- odběrová zkumavka se označí identifikačními údaji pacienta (štítkem s čárovým kódem) a těsně před odběrem v přítomnosti pacienta se zkontroluje jeho jméno
- potřebné množství odebíráme pro všechna biochemická vyšetření najednou, výjimkou jsou vyšetření STATIM
- krev je nutné dopravit včas do laboratoře (není-li to z technických důvodů možné, zasílá se do laboratoře jen krevní sérum nebo plazma)
- nádoby, do kterých krev odebíráme pro získání séra, musí být vždy čisté a suché, pro získání plazmy čisté a s přídavkem antikoagulačního prostředku, v současné době se používají uzavřené vakuové odběrové systémy
Nejčastější závady při odběru krve:
- záměna zkumavek
- hemolýza
Při hemolýze vadí jak vznik červeného zbarvení při fotometrických stanoveních, tak i to, že obsah erytrocytů se vylije do séra, což ovlivní koncentraci složek séra.
- pozdní oddělení séra od krevního koláče, kdy řada složek může přejít z erytrocytů do séra (př. K+, ACP...); oddělení séra od krevního koláče je nejlépe provést do 30 min, nejdéle 1 h po odběru.
- dlouhodobé zaškrcení paže (škrtidlo může být aplikováno maximálně jednu minutu, opakované použití je možné nejdříve až po dvou minutách)
- opakované intenzivní “pumpování” zaškrcenou paží – stačí pouze sevření ruky v pěst před vpichem
- pozdní dodání vzorku do laboratoře
- použití nevhodných zkumavek (nevhodného protisrážlivého činidla)
Pozor! Hodnoty jednotlivých složek v kapilární krvi nemusí být totožné s hodnotami v séru!
Ovlivnění biochemických analýz léky:
- některá antibiotika – zvyšují proteinurii
- karotenoidy – zvyšují koncentraci bilirubinu
- podání morfia – zvyšuje aktivitu AMS
- salicyláty – snižují koncentraci kyseliny močové
- vitamin C
Vliv světla:
Např. u stanovení bilirubinu je nutné chránit krev před světlem, protože bilirubin je fotolabilní (účinkem světla dochází k urychlení oxidace bilirubinu na biliverdin a tím ke zkreslení výsledku).
Krevní sérum neobsahuje fibrin a jiné faktory srážlivosti.
Krev se nechá stát v odběrové zkumavce při laboratorní teplotě. Po několika minutách se krev srazí a vzniká krevní koláč tzv. koagulum. Za několik hodin se odděluje sérum od koláče. Tento proces se urychluje centrifugací (při 800 – 1000 g).
Pozor! Předčasné odstředění bez dokonalého sražení krve vede k hemolýze! Oddělené sérum se umístí do čisté zkumavky, aby se předešlo případné hemolýze. Při použití zkumavky se separačním gelem oddělení do čisté zkumavky se neprovádí.
Krevní plazma
Odběr krve se provádí do nádoby s přídavkem protisrážlivého prostředku. Předepsaný poměr antikoagulačního prostředku a krve je nutno zachovat. Obsah se důkladně krouživým pohybem promíchá (netřepat!), zcentrifuguje a stáhne se plazma.
Antikoagulační prostředky
Příklady antikoagulačních prostředků a jejich použití:
+
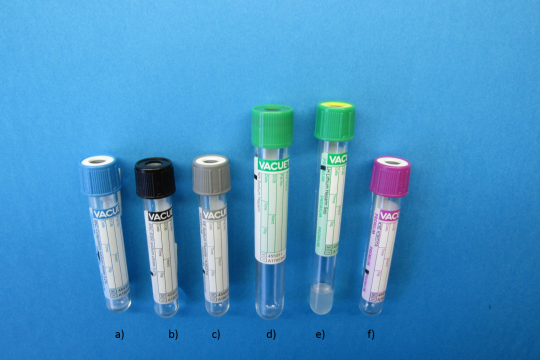
Obr. 6. Zkumavky s aditivy
- citrát sodný – stanovení sedimentace erytrocytů a hemokoagulační vyšetření (3 mg/ml) – Obr. 6a a 6b
- fluorid sodný (inhibitor glykolýzy) s K3EDTA – stanovení glukózy a laktátu v krvi – Obr. 6c
- heparin (0,5 – 2 mg/1 ml krve) – často se používají soli heparinu: amonium heparinát (vadí při stanovení NH4), heparinát sodný (vadí při stanovení sodíku) – Obr. 6d, heparinát lithný – nejčastěji používané aditivum pro všechna rutinní biochemická vyšetření (vadí při stanovení lithia) – Obr. 6e
- šťavelan lithný – 0,2 mg/ml
- šťavelan sodný – 2 mg/ml
- komplexon III (Na2EDTA) – (1 – 2 mg/ml)
- K3EDTA – stanovení krevního obrazu, glykovaného hemoglobinu aj. – Obr. 6f
Poznámka
Žádný antikoagulační prostředek nemá univerzální použití!
V případě, že plná krev nemůže být dostatečně rychle dopravena do laboratoře k oddělení séra nebo plazmy od krevních elementů, je vhodné použít zkumavky se separačními gely
+
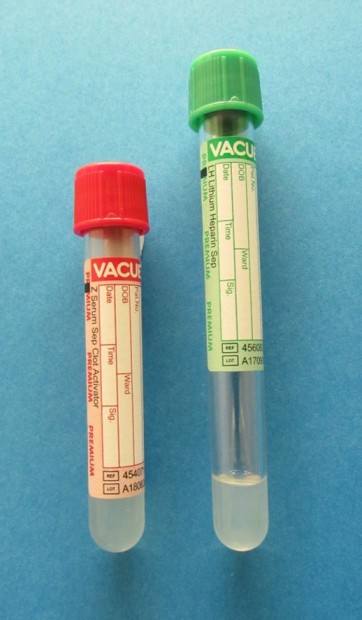
Obr. 7. Zkumavky se separačními gely
a před transportem provést centrifugaci.
Vzhled séra
+

Obr. 8. Vzhled séra
- normální – slámově žluté, průhledné
- hemolytické – růžové až červené (přítomnost hemoglobinu)
- chylózní – mléčně zakalené (přítomnost triacylglycerolů)
- ikterické – tmavě žluté až oranžové (vysoká koncentrace bilirubinu)